
题目列表(包括答案和解析)
1.根据我省中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的 ( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
19.(10分)某固体A的化学式为NH5,在NH5中的所有原子的最外层电子都具有稀有气体原子的最外层电子结构的特点,请回答:
(1)固体A的电子式应表示为 ,它的晶体类型属于 。
(2)固体A具有强还原性,与水反应时有气体放出,表示这个反应的离子方程式为
,与盐酸反应速率比与水反应时 。(填“快”“慢”“相同”)
(3)固体A的热稳定性很弱,适当加热会分解生成两种气体,表示这个反应的化学方程式为 。
附加题:
铁与HNO3作用时,还原产物除了与HNO3浓度有关外,还与温度有关。已知在与冷稀HNO3反应时,主要还原产物为NO气体;在与热的稀HNO3作用时,主要还原产物为N2O气体;当HNO3更稀时,其主要还原产物是NH4+。现有铁与稀HNO3的反应,请分析下图,回答有关问题。
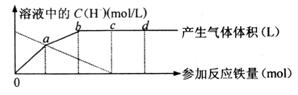
假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 。
(2) a点到b点的还原产物是 ,其原因是 ;
(3)试完成b点到c点的反应方程式:
 Fe+ HNO3? Fe(NO3)3+
+ H2O
Fe+ HNO3? Fe(NO3)3+
+ H2O
(4)反应过程中,到达 点时HNO3已完全反应;
(5) 已知到达d点时,反应结束,此时溶液中的主要阳离子是 ;
(6) c点和d点参加反应的铁的物质的量之比是 。
18.(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表格回答下列问题:
(1)硒的熔点范围可能是 碲的化合价可能有
(2)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)
 (3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________。
(3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________。
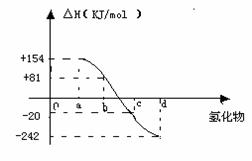
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物放出或吸收的热量叫该化合物的生成热。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。请回答下列问题:
①写出氧族元素中含18电子的两种氢化物的电子式__ __________
②请你归纳:非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系________________________
③写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:____ _____________________
17.(10分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。

(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在______________中进行。
②工业上制备甲的反应条件是__________。
③反应Ⅰ的化学方程式是___________________________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是____________。
②D的溶液与乙反应的离子方程式是__________________________________。
16.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A.11.2克 B.16.8克 C.19.6克 D.22.4克
姓名 得分
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.密闭容器中,300℃时将100mL由H2O、CO2、H2和CO组成的混合气体与足量的Na2O2在连续电火花作用下充分反应后,容器内压强只有原来的五分之一,则原混合气体中各组分的体积比不可能是
A.1∶1∶1∶1 B.3∶1∶2∶4 C.1∶3∶5∶1 D.2∶2∶3∶3
14.氯酸(HClO3)是一种强氧化性酸。若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
13.下列溶液中通入足量SO2后,最终一定会出现沉淀的是
A.Na2S B.BaCl2 C.Ba(NO3)2 D.Ca(OH)2
12.下列关于浓硫酸的叙述正确的是:
A. 浓硫酸是一种干燥剂,能够干燥硫化氢、二氧化硫等气体
B.浓硫酸具有脱水性,因而能使蔗糖、纸张、木柴等炭化
C.浓硫酸常温下能使铁、铜、锌等金属钝化
D.浓硫酸氧化性强于稀硫酸,所以浓硫酸与镁、锌等金属反应不但有二氧化硫生成还可能有氢气生成
11.某结晶水合物分子式为A·xH2O,其式量为B,在60℃时,M克晶体完全溶于N克水中,制得饱和溶液VmL,下列表达式正确的是:
A.饱和溶液的质量分数为100M/(M+N)%
B.该饱和溶液的物质的量浓度为1000(B-18x)M/BV mol/L
C.60℃A的溶解度为100M(B-18x)/(NB+18Mx)克
D.该饱和溶液VmL中含溶质M克
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com