
题目列表(包括答案和解析)
24、(10分)
1)化学式:A_______________ B.____________
2)阳极电极反应方程式_______ ________
3)离子反应方程式
4)离子反应方程式 5)其中正确的一组是
22.(9分)
第一种是NH4Cl、_______________________。第二种是_______________________。
该白色沉淀是____________。,其离子方程式为
23(6分)由①可判断,一定存在___ ______;一定不存在_____ ___。
由②可判断,一定存在__ _______;一定不存在_____ ____.
 由③、④可判断,一定存在___ _____;可能存在的是___ _____。
由③、④可判断,一定存在___ _____;可能存在的是___ _____。
21、(14分)
(1)实验前如何检查该装置的气密性?
(2)
(3 A试管中所发生反应的化学方程式是
B中的溶液所含的溶质有(写化学式)________________ ________________。
(4)最好选用表中的___________(填编号)方法,理由是
28、(11分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g)
+ B(g) 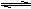 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
高三化学第二次阶段考试
班级 : 姓名 : 座号 : 分数:
第I卷(70分)
27、(10分)某复盐的组成可表示为:xA2R·yBR·zH2O,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
(1)准确称取4.02 g样品加热到失去全部结晶水,冷却后称量,质量为2.94 g.
(2)将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量Ba(NO3)2溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
(3)向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40 g.
请通过计算回答下列问题:
(1)确定R的化学式。 R的化学式______________。
(2)求x、y、z的值。 x=________,y=________,z =_________。
(3)确定A是什么元素。 A元素的名称是_____________。
(4)该复盐的化学式为______________。
(5)要确定某化合物是否含A元素,最简单方法是______________。
26、(10分)A是氮、氢两种元素组成的化合物,它与过氧化氢和水之间在结构上的关系相似。A分子中氮、氢的质量比为7:1。请填写以下空白。
①A的化学式是____________
②A的水溶液呈________(填“酸”、“碱”、“中”)性,1molA最多可与_______molHCl(或NaOH)发生中和反应形成正盐,写出形成的盐中含有氮原子的离子的电子式:_____________
③A在氧化还原反应中也与过氧化氢相似,既可作氧化剂,又可作还原剂,请根据价态分析产生这种情况的原因:____________ _________________________
25、(8分)已知:① A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素X、Y、Z的原子序数依次递增。
② X在A、B、C、D中都不呈现它的最高化合价。
③ 室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④ 化合物D受热催化分解,可制得元素Y的单质。
(1) 元素X是 ,Z是 。
(2) 写出③中反应的化学方程式: 。
(3) 写出④中反应的化学方程式: 。
24、(10分)A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,D、E均为无色气体,H为不溶于酸的白色沉淀。回答以下问题:
1)化学式:A_______________ B.____________
2)C溶液电解时,阳极电极反应方程式_______ ________
3)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式
___________________________________________________________
4) A与B溶液混合时发生反应的离子反应方程式
___________________________________________________________
(5)已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3溶液两种,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(RO32-)+c(OH-)+ c(HRO3-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(H2RO3)+2c(RO32-)+(H2RO3)
22.(9分)
氯化银、氢氧化银都能和氨水反应生成Ag(NH3)2+,Ag(NH3)2+能和H+反应:
Ag(NH3)2+ + 2H+=Ag+ +2NH4+,今有一白色固体可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的两种或三种组成,为了确定该白色固体的成分,进行以下实验:
①取白色固体少许,加入适量蒸馏水,充分振荡得无色溶液;
②取①得到的溶液少许,滴加适量的硝酸,有白色沉淀生成。
由此白色固体必须含有的物质可能有两种组合:
第一种是NH4Cl、_______________________。第二种是_______________________。
在第一种情况下加入足量的稀硝酸时仍有白色沉淀,该白色沉淀是____________。
在第二种情况下加入稀硝酸时也产生白色沉淀,其离子方程式为
23(6分)贮气袋中存有有色气体,可能是NO2、CH4、CO2、HCl、NH3、Br2蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于AgNO3溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊。则:由①可判断,一定存在___ ______;一定不存在_____ ___。由②可判断,一定存在__ _______;一定不存在_____ ____.由③、④可判断,一定存在___ _____;可能存在的是___ _____。
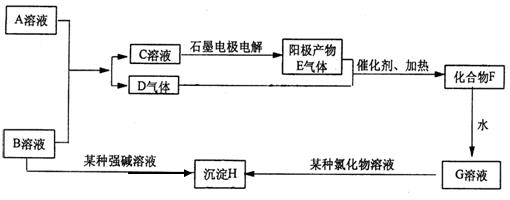
21、(14分)用右图装置,进行硝酸与铜片反应的实验,同时,
为了防止污染,在试管B里盛放足量氢氧化钠溶液,以吸收反应产生
的气体。
(1)实验前如何检查该装置的气密性?
(2)若实验使用的试剂是质量分数为63%的硝酸和小铜片,操作中怎样加入硝酸和铜片才能避免铜片与硝酸刚一接触时生成的气体外逸到空气中?_______________ _____
______________________________________________________________________________。
(3)若使用的试剂是1mol•L-1的硝酸和小铜片,则A试管中所发生反应的化学方程式是______________________________________________________________________________,实验结束后试管B中的溶液所含的溶质有(写化学式)________________________________。
(4)为了从上述实验中获得纯净的NO,拟用以下装置除去NO中的杂质,最好选用表中的___________(填编号)方法,理由是_______________________________________________
______________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com