
题目列表(包括答案和解析)
19、(12分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是:
,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体,该气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
18、(10分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是_________________________________。
(2)第④步中,相关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________。
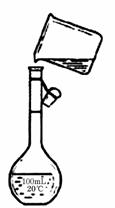
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是____________________
_______________________________________________。
17、(8分)(1)下面所列的是中学化学实验室中几种常见的仪器:
容量瓶 、酸式滴定管、碱式滴定管、温度计、量筒 、托盘天平、 普通漏斗 、烧杯
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
③使用酸式滴定管的第一步操作是 ;
④中和热测定时,一次完整实验,温度计应使用 次。
(2)下列实验最后结果与理论值相比,偏小的是
A.配制一定物质的量浓度溶液时,药品与砝码放反了,游码读数为0.3g,所得溶液的浓度
B.酸碱中和滴定时,滴定终点仰视标准液滴定管读数,所得待测液的浓度
C.中和热测定实验时,用铜质搅拌棒代替环形玻璃搅拌棒,所得的中和热的数值
D.测定硫酸铜晶体结晶水含量时,坩埚内有高温不分解的固体物质,所得到的结晶水的含量
16.某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是
A.饱和溶液的物质的量浓度为:1000a(M-18n)/M(a+b)mol/L
B.饱和溶液中溶质的质量分数为:100a(M-18n)/M(a+b)%
C.饱和溶液的体积为:(a+b)/ρL
D.25℃时,A的溶解度为:a(M-18n)/(bM+18an)g
第II卷 (非选择题 共86分)
15.能正确表示下列化学反应的离子方程式的是
A、稀硝酸与锌的反应:2H+ + Zn = H2↑ + Zn2+
B、二氧化氮通入水中:3NO2 + H2O = 2H+ + 2NO3- + NO
C、过氧化钠和水反应:Na2O2 + H2O = 2Na+ + 2OH-+O2↑
D、过量二氧化碳通入少量澄清石灰水中:CO2 + OH- = HCO3-
14.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
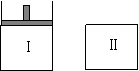
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
13.下列叙述正确的是
A.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
B.医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关
C.电泳现象可证明胶体属于电解质溶液
D.C60是由60个碳原子构成的形似足球的分子,结构对称,稳定性好
12.下列各溶液中,微粒的物质的量浓度关系正确的是:
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
11.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
10.下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液pH大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com