
题目列表(包括答案和解析)
4.下列反应中,Na2O2只表现强氧化性的是( )
A.2Na2O2+2H2O==4NaOH+O2↑
B.Na2O2+MnO2==Na2MnO4
C.2Na2O2+2H2SO4==2Na2SO4+2H2O+O2↑
D.5Na2O2+2KMnO4+8H2SO4==5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
3.铅笔是常用的学习用品,铅笔芯的主要成分是石墨和黏土。某型号的铅笔芯质量的一半成分是石墨,用该铅笔写一个化学方程式消耗的质量约1mg,那么铅笔芯中减少的碳原子数约为( )
A.2.5×1019个 B.2.5×1022个 C.5×1019个 D.5×1022个
2.下列叙述中正确的是( )
A.葡萄糖在人体内氧化分解是放热反应
B.酸碱中和反应是吸热反应
C.木柴燃烧需要用火柴点燃,所以木柴燃烧是吸热反应
D.苛性钠溶于水是放热反应
1.红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯组成,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是( )
A. Mg B. Sr C. K D. Cl
25.(10分)钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)x Cly]Clz的组成,进行如下实验:
① 称取样品0.5010g ,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL 0.5000mol·L-1 的盐酸完全吸收并用蒸馏水定容到100mL,得溶液B,取B溶液20.00mL , 用0.1000mol·L-1 NaOH滴定,消耗NaOH溶液30.00mL。
② 向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com+ + I- → Co2+ + I2(未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3溶液20.00mL 。反应方程式为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6
③ 另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)x Cly]Clz + zAgNO3=[Co(NH3)x Cly](NO3)z + zAgCl↓
通过计算求:
⑴[Co(NH3)x Cly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
第二次质量检测试卷
24.(6分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
23.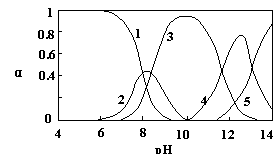 (10分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
(10分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-]
⑴Pb(NO3)2溶液中,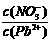 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,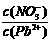 增加,可能的原因是
。
增加,可能的原因是
。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:

 离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度/(mg·L-1) 0.100 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8

上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
22、(8分)中学化学中几种常见物质的转化关系如下:
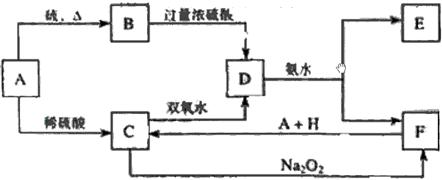
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: 。
(2)A、B、H的化学式:A 、B 、H 。
(3)①H2O2分子的电子式: 。
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象: 。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
21、(14分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强)
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L -1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中酸性的原因是(用离子方程式表示)
写出硼酸与NaOH溶液反应的化学方程式:
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
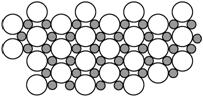 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(6)已知硼烷相对分子质量为28,该硼烷气体在空气中能剧烈燃烧,生成1mol液态水可放出722kJ的热量,请写热化学方程式:
20、(8分)某同学查资料得知α-AgI是一种固体导体,导电率很高。他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如下图所示(用铅蓄电池做电源)的电化学实验。
已知铅蓄电池总反应: Pb+PbO2+2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
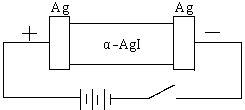
(1)该电解池的阳极电极方程式:
铅蓄电池的正极电极方程式:
(2)若Ag+导电,α-AgI本身质量将 。(填不变、变大、或变小)
若I-导电,阳极附近的α-AgI晶体密度将会 。(填不变、变大、或变小)
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com