
题目列表(包括答案和解析)
2.分解法:如2KClO3 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4 C+2H2 2H2O2
C+2H2 2H2O2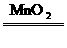 2H2O+O2↑
2H2O+O2↑
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
3.比较非金属性强弱的八条依据
(1)元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金属单质与氢气化合的越容易,非金属性越强。如F2、Cl2、Br2、I2 与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2 ;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2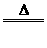 CuCl2;2Cu+S
CuCl2;2Cu+S Cu2S,说明非金属性Cl>S。
Cu2S,说明非金属性Cl>S。
(8)几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱,如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N>Br;而单质的活泼性:O2< Cl2,N2<Br2。
1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H:
21.(15分)有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可签别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是
被检出的物质的化学式(分子式)是
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是1支试管中有白色沉淀生成 ,2支试管中有蓝色沉生成
被检出的物质的化学式(分子式)是
(3)鉴别余下未检出物质的方法和观察到的现象是(i)
(ii)
20.(10分)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:
、
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入 。②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。③加入 ,使沉淀完全溶解。④ ,得到纯净的硝酸钙晶体。
19. (15分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成 ③C与D反应有沉淀生成 ④D与E反应有沉淀生成 ⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,
D是 ,E是 。
(3)A与E反应的离子方程式是 。
18. (10分) (05上海24、)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)2、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
17.(10分)(05北京29.)CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是: 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com