
题目列表(包括答案和解析)
31.(6分)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
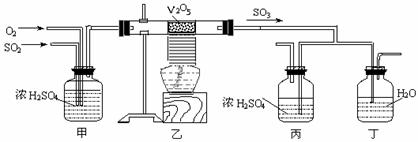
请回答下列问题:
(1) 写出沸腾炉内煅烧黄铁矿的反应方程式:______________________________ _ ____;
(2) 上图中的乙、丙分别相当于工业上制取硫酸装置中的__________________________ __;
(3) 处理尾气的方法是_____________________________ _。
30.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
 (2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。(写电极反应式)
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池
理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
29.(6分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面的问题:
(1)这几种溶液分别是甲: ,丙: 。
(2)写出乙与丁反应的离子方程式: 。
28.(12分) CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:

图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母) 。
(3)反应类型:X 、Y 、Z 。

 (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A+CO+H2O E;②F+D H。
① ;
② 。
27.(8分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
⑵M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式) ;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为 。
26.(6分)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是_________________________ ;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是______________________ __ 。从以上事实可知,ClO-、I2、SO42-的氧化性由弱到强的顺序是_____________________________。
25.下列说法正确的是
A.某二元弱酸的酸式盐NaHA溶液中: c(H+)+c(A2-)=c(OH-)十c(H2A)
B.0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合得到碱性混合溶液中:
c(Na+)> c(CN-)
C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:
c(CH3COOH)+c(CH3COO-)=0.01 mol/L
D.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:
c[(NH4)2SO4] > c(NH4HCO3) > c(NH4Cl)
第Ⅱ 卷:非选择题(共58分)
24.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
23.下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.相同物质的量浓度,相同体积的强酸与强碱溶液混合,反应后pH=7
C.原子失去电子所形成的离子,不一定具有稀有气体原子的电子层结构
D.某元素在化学变化中由化合态变为游离态,不能确定该元素一定被还原
22.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com