
题目列表(包括答案和解析)
21.某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-。现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩2.33g。
试回答下列问题:
(1)c(CO32-)=
(2)K+是否存在? ;若存在,浓度 mol/L(若不存在,则不必回答第二问)。
(3)根据以上实验,有没有哪种离子不能判断是否存在?若有,这种离子应如何进行检验?
19(5分)近期大面积持续“油荒”、“电荒”,严重影响了生产、生活,能源成了亟待解决的问题。解决能源危机,除了政策调控外,新能源的开发利用才是根本的有效途径。
⑴直馏汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5-C11范围内,如戊烷,它有三种同分异构体,其沸点由高到低的顺序为 (用结构简式表示)。
⑵科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。
即:H2(g)十1/2 O2(g)→H2O(l);△H=-285.5kJ/mol
但目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气和水蒸气反应制氢气的化学反应方程式。________________________________________。
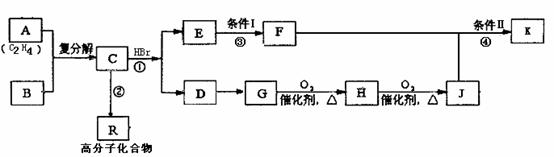
20(10分)某学生根据法国科学家YvesChauvin、美国科学家RobertH.Grubbs、RichardR.Schrock在烯烃复分解反应方面共同研究与应用的成果,结合所学的知识合成某些有机物K和R。其中K的结构简式为:C6H5CH2COOCH(CH3)C6H5
其合成路线设计如下 :
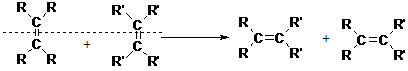
 已知:烯烃的交叉复分解反应机理为双键断裂、换位连接。可表示为:
已知:烯烃的交叉复分解反应机理为双键断裂、换位连接。可表示为:
试回答下列问题:
(1)写出B的结构简式: ,D的结构简式:
(2)①②③④中属于取代反应的有 (填序号);反应条件Ⅰ为: 。
(3)并写出④的反应化学方程式: 。
(4)写出分子式与J相同,不属于酯类化合物,结构上含有一个苯环且苯环上只有一个侧链的同分异构体的结构简式: (任写2种即可)。
17(7分)A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的1/2,B的阴离子核外只有一个电子层,C单质在标准状况下密度是1.43g·L-1,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐M 3.4 g加热反应至完全失去结晶水,其质量减少1.35 g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的-个分子中共有32个质子。试回答:
(1)A、B、C、D四种元素各是什么元素:A、 B、 C、 D 。(填元素符号)
(2)结晶盐M的化学式为 。
18(10分)右边框图中的物质是中学化学中常见的物质,已知B、E在常温下为气态,其余均为固体,其中D是一种淡黄色固体。试根据框图和所学知识回答下列问题:
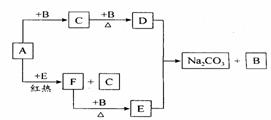
(1)写出D的化学式和E的电子式:D的化学式 、E的电子式 。
(2)A+E→C+F的反应方程式为 。
(3)往饱和Na2CO3溶液中不断通入E气体,会看到溶液变浑浊(有白色固体析出),写出该反应的化学方程式 。
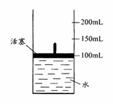 (4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)
(4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)
15(8分)请结合所学知识设计实验,证实AlO2−结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。
①能证明AlO2−结合H+的能力强于CO32−的反应的离子方程式:
_____________________________________________________。
②实验操作要点如下:
a:取少量的 溶液于试管中;
b:向试管中逐滴加入NaOH溶液直至 ;
c:向其中再滴入 溶液至足量。
16(10分)亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯(ClNO)有关性质如下:
|
分子式 |
ClNO |
别名 |
氯化亚硝酰 |
溶解性 |
溶于浓硫酸 |
|
熔点 |
-64.5℃ |
沸点 |
-5.5℃ |
性状 |
红褐色液体或有毒气体, 具有刺激恶臭,遇潮湿空气分解成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。如图所示。实验开始前K1、K3均已关闭,但K2却打开着。、
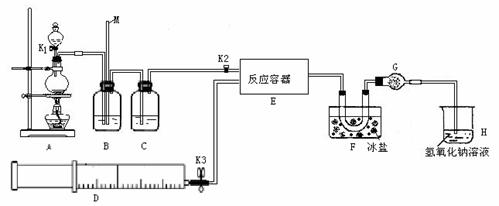
试回答下列问题:
(1)如何检查A、B、C所组成的实验装置气密性? 。
(2)若D中装有纯净的NO气体,则B中应选用最佳试剂为 ,B的作用为:① ;② 。
(3)F中U型管的作用: ;干燥管G作用: 。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO。所以装置H不能有效除去有毒气体,写出你改进措施:________________________________。
14.将4.9g Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 12g
第Ⅱ卷(共58分)
13.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知单质硅、SiO2均为空间四面体结构,Si-O、 O=O、Si-Si键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则反应Si(s) + O2(g) 高温 SiO2(s)的△H约为
A.(c+b-2a) kJ·mol-1 B.(c+b-4a) kJ·mol-1
C.(2c+b-2a) kJ·mol-1 D.(2c+b-4a) kJ·mol-1
12.下列离子方程式书写正确的是( )
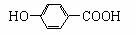 A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O
A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O 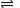 SO32-
+H3O+
SO32-
+H3O+
B.尼泊金酸( )与碳酸氢钠溶液反应:


+2HCO3- → + 2CO2↑+ 2H2O
C.电解氯化镁溶液时电极反应的离子方程式是:2Cl-+2H2O=Cl2↑+H2↑+2OH-
D.1 L 2 mol/L的FeBr2溶液中通入2.5 mol Cl2:2Fe2++8Br- + 5Cl2 =10Cl-+2Fe3++4Br2
11.室温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。a、b正确的答案组合是
A.9-11之间;0.1 B.9-11之间;0.2
C.12-13之间;0.2 D.13;0.1
10.下列操作或实验数据记录正确的是( )
A.用2 mol/L FeCl3溶液和4 mol/L NaOH溶液混合制Fe(OH)3胶体
B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液2.3mL
C.用pH试纸测溶液的pH时,应先将试纸湿润再滴待测溶液
D.在试管中制备Fe(OH)2时,将吸有NaOH溶液的滴管插入FeSO4溶液液面下
9.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
下列叙述正确的是( )
A.电解质溶液可为酸性介质
B.放电时负极反应为:Fe(OH)3
+5OH-+3e
 FeO
FeO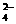 +4H2O
+4H2O
C.充电时每转移3mol电子,有1mol Fe(OH)3被氧化
D.放电时Zn为正极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com