
题目列表(包括答案和解析)
23.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 (→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 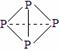 ,请画出N4H44+的结构式
。
,请画出N4H44+的结构式
。
⑷ 已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
22. (10分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔和溴发生了加成反应;
乙同学发现甲同学的实验中,褪色的溶液里有少许淡黄色浑浊,推测甲在制得的气体中还含有少量的还原性杂质气体,由此乙同学提出必先将其除去,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式:
、 。
(2)甲同学设计的实验 (填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是 (多选扣分)
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应就是加成反应
C.使溴水褪色的物质,未必是乙炔 D.使溴水褪色的物质,就是乙炔
(3)乙同学推测乙炔气体中必定含有一种杂质气体是(填化学式) ,它与溴反应的化学方程式是 。验证乙炔气体的过程中必须全部除去。
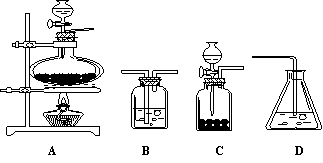 (4)如果选用下列编号为A、B、C、D的四种装置(有的可重复使用)来实现乙同学的实验方案。
(4)如果选用下列编号为A、B、C、D的四种装置(有的可重复使用)来实现乙同学的实验方案。
请你写出所选择装置编号(填在方框中)及装置中的化学药品名称(填在括号内)
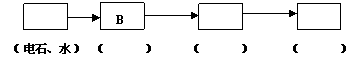
21.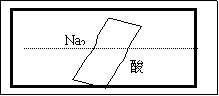 (8分)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如右图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项
(8分)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如右图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项
(多选倒扣分)。
|
序号 |
猜想物质的化学式 |
检验需要的试剂 |
操作、现象及结论 |
|
A |
Na2SO4 |
稀盐酸、氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4。 |
|
B |
Na2CO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的气体不能使品红溶液褪色而能使澄清的石灰水变浑浊,则原溶液是
Na2CO3。 |
|
C |
Na2SO3 |
稀盐酸、澄清的石灰水 |
取少量该溶液于试管中,滴入稀盐酸,如果产生无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2SO3。 |
|
D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀溶解,则原溶液是Na2SiO3溶液。 |
|
E |
Na2S2O3 |
稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,如果溶液变浑浊(或产生淡黄色沉淀),并产生无色有剌激性气味的气体,则原溶液是Na2S2O3溶液。 |
除上述五种可能之外,写出你认为还有可能物质的化学式(1种): 。
20. (10分)实验室配制500mL0.1molLNa2CO3溶液,回答下列问题:
(1)应用托盘天平准确称取十水碳酸钠晶体 g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在左盘上,天平平衡时,则实际称量的碳酸钠晶体是 g(1g以下用游码)。
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号是:
(同一标号有的可用多次)。
A.调整零点 B.将游码移到刻度尺的零刻度处 C.将碳酸钠晶体放入小烧杯中和称量 D.称量空的小烧杯 E.将砝码放回砝码盒内 F.记录称量结果
(4)配制碳酸钠溶液时需要的主要仪器有(选填序号,多选倒扣分) 。
A.500mL容量瓶 B.烧杯 C.玻璃棒 D.分液漏斗 E.250mL容量瓶 F.移液管
(5)在下列实验操作中,溶液的浓度是偏高、偏低还是不变?
① 洗涤容量瓶后容量瓶中还残存有少量蒸馏水 ;②加水时不小心水越过刻度线 ;③定容后摇匀液面低于刻度线 ;④定容时俯视刻度线 。
19、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4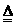 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1 molKClO3参加反应有2mol电子转移
第Ⅱ卷(非选择题,共83分)
18、关于化学平衡常数的叙述正确的是
A.温度一定时,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc,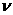 正 <
正 <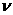 逆
逆
17、类推的思维方法在化学学习和研究中常回产生错误的结论,因此类推出的结论要经过实践的检验才能决定其正确与否.下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4可写成PbO·Pb2O3
C.不能用电解熔融AlCl3来制取金属铝;也不能用电解熔融MgCl2来制取金属镁
D.Fe与S直接化合生成FeS;Al与S直接化合也可以生成Al2S3
16、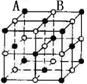 现有四种晶体,其离子排列方式如图所示,其中化学式正确的是
现有四种晶体,其离子排列方式如图所示,其中化学式正确的是
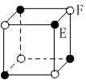
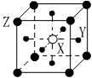
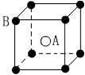
AB2 EF2 XY3Z AB
A. B. C. D.
15、下列叙述正确的是
A.酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K时活性更强
B.医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关
C.银制品久置于干燥的空气中因电化学腐蚀表面变暗
D.C60是由60个碳原子构成的形似足球的分子,结构对称,稳定性好
14、下列有关实验操作中,正确的是
A.将新配制的O.1mol·L-1的NaOH溶液转移到干燥、洁净、带橡胶塞的无色细口瓶中
B.向溶液中通入足量的氯气,以除去Fe2(SO4)3溶液中FeSO4
C.在中和滴定实验过程中,目光应密切注视滴定管中的液面变化
D.在电压的作用下,液晶分子能沿电场方向排列,移去电场后,液晶分子仍能沿电场方向排列
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com