
题目列表(包括答案和解析)
6、下列叙述正确的是
A.同周期非金属元素的原子半径越小,其单质的沸点越高。
B.同周期元素形成的简单离子,核电荷数越大半径越大。
C.同周期主族元素的原子半径越大,其原子越易失去电子。
D.同周期非金属元素的原子半径越大,其气态氢化物越稳定。
5、为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入
A.水;无水CaCl2固体 B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2CO3溶液;稀H2SO4
4、常温条件下能溶于浓HNO3的金属是
A.Al B.Fe C.Cu D.Pt
3、科学研究发现,用10B合成的10B20有较好的抗癌作用,下列说法中正确的是
A.10B和10B20互为同位素 B.10B20是一种熔点高,硬度大的物质
C.10B和10B20互为同分异构体 D.10B的中子数与核外电子数相等
2、氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
1、随着私家车的不断增多,汽车尾气对环境的污染成为人们关注的焦点,下列不属于汽车尾气中所含主要化合物的是
A.碳氧化合物 B.碳氢化合物 C.氟氯烃 D.氮氧化合物
27、(12分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg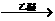 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
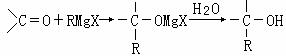
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性。合成线路如下:
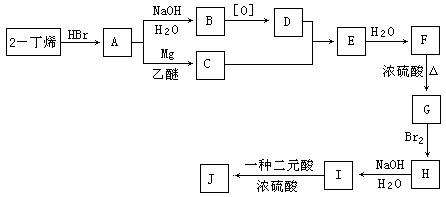
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。

26. (11分)从某些植物树叶提取的挥发油中含有下列主要成分:
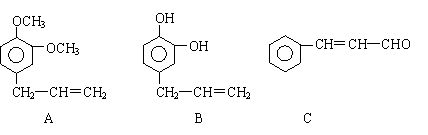
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C满足下列条件的同分异构体3种:①含苯环且其环上有两个取代基
②遇FeCl3溶液发生显色反应。
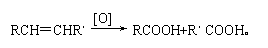 ;
;
。
;
;
。
(4)已知: 写出C在强氧化剂条件下生成
的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
25、(12分)接触法制硫酸的核心反应是
2SO2(g) + O2(g)  2SO3(g) ,其△H<0。
2SO3(g) ,其△H<0。
(1)该反应的平衡常数表达式为_______________________,升高温度,K值将_______(“增大”、“减小”、“不变”)。
(2)该反应在接触室进行,从提高能源利用率考虑,接触室内装有_______________(填设备名称)。
(3)生产中用过量的空气能使SO2的转化率____(填“增大”、“减小”、“不变”),该反应为何在常压下进行______,选择400℃的主要原因是___________。
 (4)右图是反应过程中,体系内
(4)右图是反应过程中,体系内
各物质浓度的变化情况。t2-t3
时曲线发生变化的原因是
________________,t2时二
氧化硫的转化率是________
_______;若在t4时将氧气的
浓度增大0.1mol/L,请按要
求在右图画出变化情况。
24.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。W是由两种短周期元素组成,其与水的反应可类比电石与水的反应。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I三种物质中都含有同一种的短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
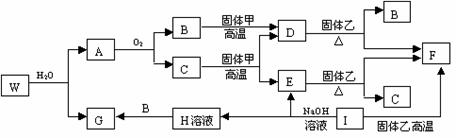

⑴ B的电子式为 ,I原子的结构示意图______________。
⑵ 有上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B 等反应中有多个反应属于置换反应,根据要求写出反应式。
非金属元素之间的置换反应____________________________________________;
金属单质置换非金属的置换反应________________________________________;
⑶ 写出W和水反应的化学方程式_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com