
题目列表(包括答案和解析)
20.(5分)根据氧化还原反应2FeCl3+Fe=3FeCl2,设计一个原电池,用 做负极,电极反应为 ;电解质溶液是 ;用 做正极,电极反应为 。
19.(6分)有一质量为Wg,相对分子质量为b的某种碱M(OH)2,在一定温度下完全溶解为Vml的饱和溶液。若溶液的密度为d g/cm3,则溶液的物质的量浓度是 ,溶质的质量分数是 ,该温度下的溶解度是 。
18.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别

在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是 ( )
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为Fe(OH)2+2e-=Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
第Ⅱ卷(非选择题46分)
17. 1998年两位希腊化学家在《科学》杂志上发表论文,称他
1998年两位希腊化学家在《科学》杂志上发表论文,称他
们在常压 下把氢气和用氦气稀释的氮气分别通入一个加热
到570℃的电解池(如右图)中,氢气和氮气在电极上合成了
氨气,且转化率达到了78%。用来合成的电解质在电解池中
起传导H+的作用,它是一种固体复合氧化物(缩写为SCY),
电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。下列说法中不正确的是 ( )
A.阳极的反应式为 H2-2e - =2H+
B.阴极的反应式为 N2+6e - +6H+=2NH3
C.电解的总反应式 N2+3H2 2NH3
2NH3
D.电解的总反应式 3H++N3- NH3
NH3
16.在恒温恒容的密闭容器中放入一定量的NO2,发生反应 2NO2(g) N2O4(g);
N2O4(g);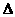 H<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是 ( )
H<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是 ( )
A.降低温度 B.通入NO2 C.通入N2O4 D.升高温度
15.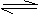 某可逆反应:mA(气)+nB(气) pC(气)(焓变为
某可逆反应:mA(气)+nB(气) pC(气)(焓变为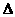 H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是 ( )
H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是 ( )
 A.m+n>p
A.m+n>p 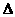 H>0
H>0
B.m+n>p 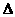 H<0
H<0
C.m+n<p 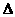 H>0
H>0
D.m+n<p 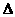 H<0
H<0
14.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
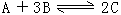 ,若维持温度和压强不变,英才当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ( )
,若维持温度和压强不变,英才当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ( )
①原混合气体体积为1.2VL; ②原混合气体的体积为1.1VL;
③反应达平衡时气体A消耗0.05VL; ④反应达平衡时气体B消耗掉0.05VL。
A.②③ B.②④ C.①③ D.②①
13.下列物质中能够与酸反应生成盐和水,但不属于碱性氧化物的是 ( )
A.Na2O B.Na2O2 C. Na D.CuO
12.我国发射“神五”所用的“长征2号”火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是N2O4,燃烧的产物若只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=2NO2(g);△H= + 67.7 kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H= - 534 kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H= -1135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H= +1135.7 kJ·mol-1
C.N2H4(g)+NO2(g)=3/2 N2(g)+2H2O(g);△H= -1135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H= -1135.7 kJ·mol-1
11.把Ba(OH)2溶液逐滴滴入明矾溶液中,使SO42ˉ全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 ( )
A.Al3+ B.Al(OH)3
C.AlO2ˉ 或 [Al(OH)4]- D.Al3+和Al(OH)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com