
题目列表(包括答案和解析)
11.下列叙述中正确的是( AC )
A.含有阳离子的晶体不一定是离子晶体,但是含有阴离子的晶体一定是离子晶体
B.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
C.在Fe(OH)3胶体中逐滴加入一定浓度的H2SO4 溶液,首先有沉淀产生,继续加入H2SO4 溶液,沉淀将消失
D.原电池正极和电解池阳极所发生的反应都是还原反应
10.下列离子方程式正确的是(BC )
A.向CaCl2 溶液中通入少量CO2 气体:Ca2+ + CO2 + H2O = CaCO3↓ +2H+
B.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu = 2Fe2++Cu2+
C.Al Cl3溶液中投入过量Na:Al 3+ + 4Na + 2H2O = AlO2-+ 4Na+ + 2H2↑
D.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液 :
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
9. 一定能在下列溶液中大量共存的离子组是( A )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
8.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4_→Mn2+; Cl2→2C1_;HNO3→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( B )
A.Fe3+ B.MnO4_ C.C12 D.HNO3
7.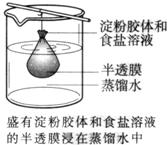 将10 mL淀粉胶体和5
mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2 min后分别取袋内和烧杯内液体进行实验。下列说法一定正确的是( A )
将10 mL淀粉胶体和5
mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2 min后分别取袋内和烧杯内液体进行实验。下列说法一定正确的是( A )
A.烧杯内液体加入硝酸银溶液后有白色沉淀产生
B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入硝酸银溶液后无变化
D.袋内液体加入碘水后不变蓝
6.表示下列变化的化学用语正确的是 ( D )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O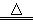 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.电解硫酸铜溶液的阳极反应为:Cu2++2e- = Cu
C.钢铁吸氧腐蚀的正极反应:4OH--4e-=O2+2H2O
D.1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1) ;△H=-114.6 kJ/mol
5.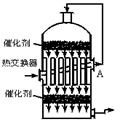 在硫酸工业生产过程中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室,按此密闭体系中气体的流向,则在A处流出的气体主要为( C )
在硫酸工业生产过程中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室,按此密闭体系中气体的流向,则在A处流出的气体主要为( C )
A.SO2 B.SO3、O2
C.SO2、O2 D.SO2、SO3
4.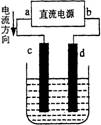 如图是电解CuCl2溶液的装置,其中c、d为石墨
如图是电解CuCl2溶液的装置,其中c、d为石墨
电极。则下列有关判断正确的是 ( C )
A.a为负极,b为正极
B.c为阴极,d为阳极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
3.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( C )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
2.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= -285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= -283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= -5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= -890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最多的是( A )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com