
题目列表(包括答案和解析)
24、(8分) 治理硝酸工业中的尾气中的氮氧化物(NO、NO2)的化学原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O。
现有标准状况下的a LNO2(其中N2O4的体积分数为20%)、b LNO的混合气体,恰好被200mL一定浓度的NaOH溶液完全吸收。
⑴根据上述条件可知,a∶b的值应在 范围中;
⑵设生成的NaNO3的物质的量为n1,NaNO2的物质的量为n2
①当产物全部为NaNO2时,求n2的值;
②当产物中兼有NaNO3和NaNO2时,求n1和n2的值;
③求上述NaOH溶液的物质的量浓度。
23、(12分)有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的,图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等。A的烃基上的一氯取代位置有三种。
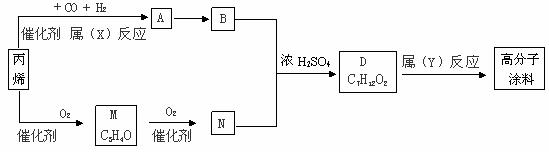 试写出:
试写出:
(1)物质的结构简式,A: ,M: ,物质A的同类别的同分异构体为: ;
(2)N+B®D的化学方程式为: ;
(3)反应类型:X ,Y: 。
22、(8分)有机物X(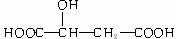 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)在一定条件下有机物X可发生化学反应的类型有(填序号)_____。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(2)写出X与金属钠发生反应的化学方程式: 。
(3)与X互为同分异构体的是(填序号)_ __________。
a.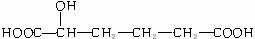 b.
b.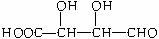
c.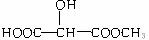 d.H3COOC-COOCH3
d.H3COOC-COOCH3
e. f.
f.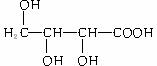
(4)写出X与O2在铜作催化剂加热的条件下发生反应所得到的可能产物的结构简式
。
21、(10分)已知反应:AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平),不必配平此方程式,判断:
(1)若Cl2的系数为a,则AgF的系数为 ,判断的依据是
。
(2)若AgClO3的系数为b,O2的系数为c,则AgCl的系数为 ,判断的依据
是 。
(3)在水溶液中N2H5+离子将Fe3+还原成Fe2+,发生如下反应:
N2H5++4Fe3+→4Fe2++Y+…,作为N2H5+的氧化产物Y可能是(填写化学式) 。
20、(8分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________;
(2)实验④中的现象为:_______________ ;
(3)实验②③反应的离子方程式分别是:______ _________________、___________________________ __。
19、(12分)(1)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I– 2CuI↓+ I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈现蓝色,对这个现象解释正确的是:_____________(填序号)。
①阴极电极反应2H+ + 2e – H2↑,使c (OH – ) > c (H+)
②阳极2Cu + 4I – – 4e – 2CuI↓+ I2,I2遇淀粉变蓝
③阳极Cu – 2e – Cu2+,Cu2+ 显蓝色
④阳极2I – – 2e – I2,碘遇淀粉变蓝
(2)剪约6 cm长,2 cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40 mL浓HNO3,另一只烧杯中注入40 mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。电流表指针偏向________(填“铝”或“铜”)
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_____________________________。电流表指针偏向________(填“铝”或“铜”)
18、(12分)在测定硫酸铜结晶水的实验操作中:
⑴、加热前应将晶体放在 中研碎,加热是放在 中进行;加热失水后,应放在 中冷却。
⑵、判断是否完全失去结晶水定性实验是 。
⑶、做此实验,最少应进行称量操作 次。
(4)、下面是一位学生测定硫酸铜晶体中结晶水的质量分数的实验记录
|
坩埚质量 |
坩埚质量+硫酸铜晶体质量 |
坩埚质量+无水硫酸铜质量 |
|
15.0 g |
17.5 g |
16.6 g |
硫酸铜晶体的化学式是
17、(6分)⑴下列实验设计或操作合理的是_____________(填字母)。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2) 根据现有中学化学知识,判断下列有关实验描述正确的是 (填字母)。
A. 红砖中氧化铁成分检验用到的试剂是盐酸和硫氰化钾溶液
B. 用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C. 中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D. 实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
E.实验窜制备乙酸乙酯时吸收液为饱和碳酸钠溶液而不用饱和碳酸氢钠溶液
16、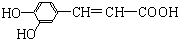 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 。下列有关咖啡酸的说法中,不正确的是
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 。下列有关咖啡酸的说法中,不正确的是
A.咖啡酸可以发生还原、取代、加聚等反应
B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应
D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
第二卷(非选择题 共86分)
15、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH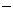 、SO
、SO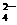
C.K+、NO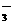 、SO
、SO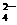 、OH-、Na+ D. MnO
、OH-、Na+ D. MnO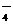 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO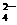
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com