
题目列表(包括答案和解析)
13、下列实验操作中错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
11阿佛加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.标准状况下,2.24L苯中约含有3.612×1023 个碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1023个电子
12、一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B 3C B.A+B
3C B.A+B 2C
2C
C.2A+B C D.A+B
C D.A+B 3C
3C
10、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4] 2+不会与乙醇发生反应
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
9、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质, 被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 +3 C 高温 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.氮化铝中氮元素的化合价为-3
C.上述反应中每生成2 mol AlN,N2得到3 mol电子
D.氮化铝晶体属于分子晶体
8、如右图所示,在一U型管中装入含有紫色石蕊的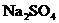 试液,
试液,
通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,
从左到右颜色的次序是
A.蓝、紫、红 B.红、蓝、紫
C.红、紫、蓝 D.紫、红、蓝
7、下列离子方程式书写不正确的是
A.Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.硫酸铝中加入过量氨水 Al3++3OH-=Al(OH)3↓
 C.K2S溶液显碱性的原因:S2-+2H2O=H2S+2OH-
C.K2S溶液显碱性的原因:S2-+2H2O=H2S+2OH-
D.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O=Ag(NH3)2++2H2O
6、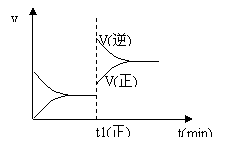 下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g) ΔH<0
B.2SO2(g)+O2(g) ⇌ 2SO3(g) ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g) ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g) ΔH>0
5、下列各式中,属于正确的电离方程式的是
A.HCO3- + H2O  H2CO3
+ OH- B.HCO3- +OH- ====
H2O + CO32-
H2CO3
+ OH- B.HCO3- +OH- ====
H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O  NH4+ +
OH-
NH4+ +
OH-
4、.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
 HIn(溶液)
H+(溶液)+In-(溶液)
HIn(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
3、用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是
①再加入30毫升3摩/升盐酸 ②改用30毫升6摩/升盐酸
③改用3克粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D. ①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com