
题目列表(包括答案和解析)
23.(6分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则(1)混合气体中CO的质量是 g; (2)混合气体中CO2在标准状况下的体积是 L;
(3)混合气体在标准状况下的密度是 g·L-1。
22.(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
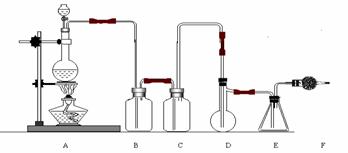
试回答下列问题:
(1)装置A中发生反应的化学方程式为:
(2)装置C盛放的药品是
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。
(5)F装置中干燥管内所盛物质的作用是:
。
21.(4分)下列有关叙述正确的是__________________(填序号,错选倒扣分)
①用小刀切割一小块金属钠后,所剩钠块必须放回原试剂瓶中
②配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
③用托盘天平称取10.5gNaCl,若药品和砝码位置放颠倒,则称取的NaCl质量偏大
④做焰色反应实验时,若火焰呈黄色,则肯定不含有钾元素
⑤能使湿润的碘化钾淀粉试纸变蓝色的气体一定是氯气
⑥氯水应存放在棕色试剂瓶中
⑦碱金属单质都应存放在煤油中
20.为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2 + 2NaOH→2NaNO3 + NO + H2O;NO2 + NO + 2NaOH→2NaNO2)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
A.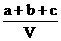 mol/L B.
mol/L B.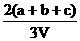 mol/L
mol/L
C.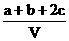 mol/L D.
mol/L D.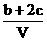 mol/L
mol/L
保密★启用前 试卷类型:A
高三化学上学期期中考试评估卷
高三化学试题
第Ⅱ卷(共50分)
19.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
18.同温同压下,两个容积相等的储气瓶,一个装满HCl气体,另一个装满H2和Cl2的混合气体,则两瓶内的气体一定具有相同的
A.质量 B.密度 C. 原子总数 D. 质子总数
17.下列事实与氢键有关的是
A.水加热到很高温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
16. 砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷原子最外层有3个电子
B.砷化氢(AsH3)比NH3稳定
C.砷酸(H3AsO4)的酸性强于磷酸
D.砷的+3价化合物的毒性强于+5价化合物
15.设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是
A.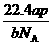 B.
B. C.
C.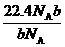 D.
D.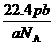
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
C.1 mol Na2O2与足量的水反应,转移的电子数为2NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com