
题目列表(包括答案和解析)
7.在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:

(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
6.在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
|
序号 |
锌的质量(g) |
锌的形状 |
温度(℃) |
完全溶解于 酸的时间(s) |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
30 |
t1 |
|
E |
2 |
薄片 |
35 |
50 |
|
F |
2 |
颗粒 |
15 |
t2 |
|
G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是 ①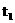 =75s ②
=75s ②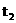 >200>
>200>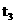 ③单位时间内消耗的锌的质量
③单位时间内消耗的锌的质量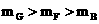
A.① B.①② C.只有② D.全部正确
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|
班级__________ 姓名______________( )
5.在恒温恒压下,将3molA和1molB放入一密闭容器中发生反应:2A(g)+B(g) 2C(g),达到化学平衡(Ⅰ)。在同样条件下,3molA和2molB发生同样的反应,达到化学平衡(Ⅱ)。现将平衡(Ⅱ)的混合气全部压入平衡(Ⅰ)的容器中,在同样条件下达到化学平衡(Ⅲ)。下面关于平衡(Ⅰ)、(Ⅱ)、(Ⅲ)的说法错误的是:
2C(g),达到化学平衡(Ⅰ)。在同样条件下,3molA和2molB发生同样的反应,达到化学平衡(Ⅱ)。现将平衡(Ⅱ)的混合气全部压入平衡(Ⅰ)的容器中,在同样条件下达到化学平衡(Ⅲ)。下面关于平衡(Ⅰ)、(Ⅱ)、(Ⅲ)的说法错误的是:
A.平衡(Ⅲ)中A的转化率等于B的转化率 B.平衡(Ⅰ)中A的转化率小于B的转化率
C.n(C)/n(A)的比值,平衡(Ⅲ)中比平衡(Ⅰ)中小 D.n(A)/n(B)的比值,平衡(Ⅲ)中比平衡(Ⅱ)中大
4.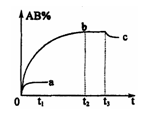 反应
反应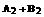
 2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如下图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间
2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如下图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间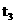 开始向容器中加压的情况.则下列叙述正确的是 A.
开始向容器中加压的情况.则下列叙述正确的是 A.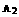 、
、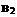 及AB均为气体,Q>0
及AB均为气体,Q>0
B.AB为气体,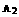 、
、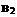 中至少有一种为非气体,Q<0
中至少有一种为非气体,Q<0
C.AB为气体,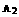 、
、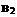 中有一种为非气体,Q<0
中有一种为非气体,Q<0
D.AB为固体,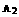 、
、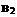 中有一种为非气体,Q>0
中有一种为非气体,Q>0
3.下列有关铁的描述正确的是
A.熔点比生铁低 B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易腐蚀 D.常温下在冷浓硝酸中可钝化
2.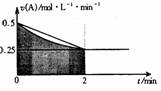 某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是:
A.图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
1.在恒温恒容条件下,将4molA和2molB放入一密闭容器中发生反应:2A(g)+B(g) 2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达到平衡时,C的体积分数不等于a的是:
A.4mol、2mol、0mol、2mol B.2mol、1mol、2mol、2mol
C.2mol、1mol、2mol、1mol D.2mol、1mol、0mol、1mol
25. (10分 ) 将一块部分被氧化的金属钠固体(假设氧化产物只有Na202) 放入盛满水且倒置水槽内的容器中,此时在容器中可收集到448mL(标准状况)气体(假定各步反应完全,并产生的所有气被全部被收集到容器中 ), 以电火花引燃容器里的气体 , 最终剩余112mL(标准状况)气体。求固体中钠及 Na202 的物质的量。
24. (6分)时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I- 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度. 主要步骤如是 :
①在100.00mL中性溶液中,用溴将试样中I- 氧化成IO3- ,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I- ,方程式为:
N2H4+2I2= 4I-+N2+ 4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的 KI溶液 ,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂 ,用Na2S203 标准溶液滴定 , 方程式为 :
2Na2S203+I2=Na2S406+2NaI
消耗0.1000mol/LNa2S2O3溶液60.00mL。
试计算原溶液中I-的物质的量浓度。
23. (12 分 ) 己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。
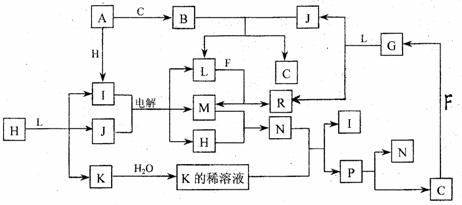
常温下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 :
(l)P的结构式为_____________________;B 的电子式为___________________;
(2)R水溶液呈碱性的原因可用离子方程式表示为
_______________________________________________________________________;
(3)还有一种物质能与B反应生成C.写出这个反应的化学方程式
_______________________________________________________________________;
(4)还有一种物质能与J反应生成C,写出这个反应的化学方程式
_______________________________________________________________________;
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com