
题目列表(包括答案和解析)
6、下列说法或表示法正确的是
A、等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B、由C(石墨)→C(金刚石):ΔH = +119 kJ· mol-1可知,金刚石比石墨稳定
C、在稀溶液中:H++OH-===H2O;ΔH = -57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol-1
5、物质的量浓度均为0.01mol·L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为
A.≥7 B.一定>7 C.≤7 D.可能=7
4、25℃时,pH为9的Na2CO3溶液和pH为5的FeCl3溶液中,水的电离程度的大小关系是
A.两者相等 B.前者大 C.后者大 D.无法确定
3、在蒸发皿中加热蒸干并灼热(低于400℃)下列物质的溶液,可以得到该物质固体的是
A、氯化铝 B、高锰酸钾 C、碳酸镁 D、碳酸钠
2、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入一定量下列物质,溶液恰好恢复到电解前状态。则该物质为
A.CuSO4 B.Cu(OH)2 C.CuO D.Cu
1、一定条件下,可逆反应C(s) + CO2(g)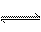 2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A、①②③④ B、①③ C、①② D、①③④
26.(6分)将K CO
CO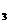 、KHCO
、KHCO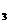 混合粉末m g加热到质量不再减少为止,剩余物质的质量为m
混合粉末m g加热到质量不再减少为止,剩余物质的质量为m
g,则:
(1)
混合物中K CO
CO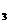 的质量为___________g。
的质量为___________g。
(2) 题干条件中n的数值应满足的范围是__________。
(3) 若将加热前的该混合粉末与足量盐酸反应,将所得溶液蒸干,可得KCl固体的质量为_________________g。
25.(5分)在通常情况下,a L H S气体和b L O
S气体和b L O 在密闭容器中充分反应后恢复至室温,求容器中剩余气体的体积及成份。
在密闭容器中充分反应后恢复至室温,求容器中剩余气体的体积及成份。
24.(6分)有A、B、C、D四种元素。常温下A的单质是深红棕色的液体。B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子数的两倍。C、D元素原子最外层电子数相同,C元素原子核内质子数是D元素原子核内质子数的1/2。
(1) 各元素的符号是A:_____________、B:_____________、C:_____________、D_____________。
(2) 由上述元素组成的单质或化合物相互反应生成沉淀的两个反应方程式是__________、___________。
23.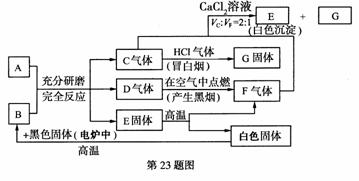 (7分)如图,每一个方框表示有关的反应物或生成物。其中A是一种潮湿的酸式盐,试
(7分)如图,每一个方框表示有关的反应物或生成物。其中A是一种潮湿的酸式盐,试
回答:
(1) A是_______________,B是_______________。(填化学式)
(2) 潮湿的A与B混合研磨时有关化学方程式是___________,___________________,________________________。
(3)
C、F通入CaCl 溶液时的离子方程式是___________________________。
溶液时的离子方程式是___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com