
题目列表(包括答案和解析)
18.(12分)
2003年10月17日晨6时许,载着航天英雄杨利伟的“神舟”五号飞船在内蒙古大草原成功着陆,我国首次载人航天飞行取得圆满成功。发射“神舟”飞船的长征2号火箭用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式 。
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式 。该反应中 是氧化产物。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式 。
(4)为使宇航员有良好的生存环境,宇宙飞船中装有盛Na2O2颗粒的供氧装置,如用KO2(超氧化钾)代替Na2O2,能达到同样的目的。写出KO2与CO2反应的方程式 。
若仅从飞船携带物品宜轻便考虑,这两种物质中哪种更好,请用计算结果加以说明: 。
17.(10分)
某溶液A中含有1molFeI2和2molFeBr2
(1)向溶液A中通入2 molCl2,此时被氧化的离子是 ,被氧化的离子的物质的量分别为 。
(2)向溶液A中通入3 molCl2,则被氧化的离子是 ,其对应的氧化产物的物质的量分别为 。
(3)若溶液A中含有a mol FeI2和b molFeBr2,通入Cl2的物质的量为C mol,当溶液中Br-部分被氧化时,C的范围 (用含a、b的代数式表示)
16.标况下,由NO2、N2和NH3三种气体组成的混合气体15L,通过稀HNO3后酸液质量增加了15.9g,气体体积缩小为3.80L,则混合气体中NO2、N2、NH3三种气体的体积分别是
A.6.72 L 、1.56L、6.72L B.4.62L、5.6L、3.78L
C.6L 、8L 、7L D.6.72L、6.72L、1.56L
第Ⅱ卷 (非选择题,共86分)
15.第三周期元素R,它的原子核外最外层上达到饱和所需电子数是最内层电子数的正整数倍,则关于R的正确判断是
A.常温下,能稳定存在的R的氧化物都能与烧碱溶液反应
B.R的最高价氧化物对应的水化物为强酸
C.R的单质在固态时均属于分子晶体
D.R的气态氢化物在常温下都能稳定存在
14.在硫酸工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是
A.从沸腾炉出来的炉气必须净化,因为炉气中SO2会与杂质发生反应
B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化为SO3时需要使用催化剂,这样可提高SO2的转化率。
13.化学实验室中常将溶液或试剂进行酸化,下列酸化处理正确的是
A.定量检验C2H5Cl时,将C2H5Cl和NaOH混合后,加盐酸酸化
B.为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.鉴定检测液中是否有Fe2+时,用硝酸酸化,再加KSCN溶液
D.鉴别溶液中是否有SO42-溶液可用盐酸酸化
12.在一定条件下,Cl2和NH4Cl可发生如下反应:xCl2+yNH4Cl=yNClx+(x+y)HCl,当消耗6.72L(标况)的氯气时,生成0.10molNClx则NClx中氮的化合价为
A.2 B.3 C.4 D.5
11.将1.12gFe粉加入2mol·L-1FeCl3溶液25 ml中,充分反应后其结果是
A.Fe有剩余
B.往溶液中滴入无色KSCN溶液显红色
C.Fe2+和Fe3+物质的量之化为6:1
D.氧化产物与还原产物的物质的量之比为2∶5
10.下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应,不能将它们区分开的是
A.KNO3 、Na2SO4、CaCl2、BaCl2 B.H2SO4、Al2(SO4)3、NaCl、NaOH
C.盐酸、Na2SO4、Na2CO3、NaOH D.Na2SO4、MgSO4、Na2CO3、NaOH
9.20℃时,饱和KCl溶液的密度为1.174 g.cm-3,物质的量浓度为4.0 mol.L-1则下列说法中不正确的是
A.25℃时,饱水KCl溶液的浓度大于4.0mol·L-1
B.此溶液中KCl的质量分数为: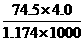 ×100%
×100%
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com