
题目列表(包括答案和解析)
6. 把10mL淀粉胶体和5mLNaCl溶液的混合液体,加入用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中(如右图)。2min后,分别取袋内和烧杯
把10mL淀粉胶体和5mLNaCl溶液的混合液体,加入用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中(如右图)。2min后,分别取袋内和烧杯
中的液体进行实验。下列有关说法正确的是 ( )
A.如果将AgNO3 溶液加入袋内液体中,产生白色沉淀,则
说明Cl-不能通过半透膜
B.如果Cl-能通过半透膜,则AgNO3 溶液加入袋内液体中,将不产生白色沉淀
C.如果将少量碘水加入袋内液体中,溶液变蓝色,则说明淀粉分子不能通过半透膜
D.如果将少量碘水加入烧杯中液体,溶液不变蓝色,则说明淀粉分子不能通过半透膜
5.有关接触法制硫酸的叙述中,不正确的是 ( )
A.SO2进入接触室前要净化,以免催化剂中毒
B.用硫铁矿代替硫,可减少环境污染
C.热交换的目的,一方面使即将参加反应的气体达到一定温度,另一方面降低SO3的温度
D.尾气经过处理后才能排放到空气中
4.下列物质性质的变化规律与分子间作用力有关的是 ( )
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.HF、HCl、HBr、HI的热稳定性依次减弱
3.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性强弱顺序是:Cl- < Fe2+ < H2O2 < I- < SO2,则下列反应中不能发生的是 ( )
A.2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42- + 4H+ B.SO2 + H2O2 == H2SO4
C.2 Fe2+ + Cl2 == 2 Fe3+ + 2Cl- D. 2 Fe2+ + I2 == 2 Fe3+ + 2I-
2.下列各组中的两种微粒,所含有的电子数不相等的是 ( )
A.Na+、Mg2+ B.F-、OH-
 C.NH4+、 OH D.CH4、H2O
C.NH4+、 OH D.CH4、H2O
1.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的核素-30P,开创了人造核素的先河。其发生的变化可表示如下:27Al+4He→30P+1n。下列有关说法不正确的是
A.30P和 31P 两种核素互为同位素 ( )
B.该变化同样遵循质量守恒定律
C.该变化说明原子核在化学反应中也能发生变化
D.在30P中存在:质子数=中子数=核外电子数
28.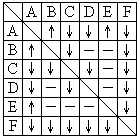 (本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
(本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
(1)请写出下列物质的化学式:
C 、D 、E 、F .
(2)写出A、B反应的离子方程式: _____________________________________________。
27.(10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
程式:
 A12Te3 + ( )
A1(OH)3↓ + H2Te↑
A12Te3 + ( )
A1(OH)3↓ + H2Te↑
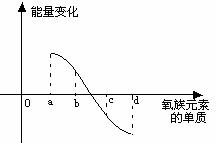
(6)右图所示为氧族元素单质与H2反应过程中的能
量变化示意图,其中a、b、c、d分别表示氧族中某
一元素的单质,△E为相同物质的量的单质与H2反应
过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
26.(9分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
25.(10分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-1离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
(4)C、D元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。
(5)用电子式表示A、C两元素形成的化合物: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com