
题目列表(包括答案和解析)
22. (11分)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比约为4.13:1, NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴江苏省大气污染特征是( )
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵请你提出江苏省防治酸雨的两条主要措施
______________________________________________
______________________________________________
⑶某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是_____________________________________________________________________
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是_______
________________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:

该反应类型属于_______________。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量;实验测得SO2含量与溶液的吸光度A的关系如下图所示。
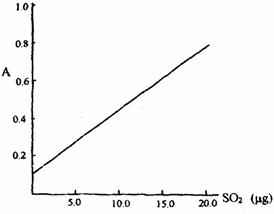
若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为__________________________________________________________
21. (12分)氢气在空气中燃烧生成水:2H2+O2=2H2O,这是人人皆知的常识,但有同学会提出:氢气在空气中燃烧会不会生成H2O2:H2+O2=H2O2?根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组设计了如下图“验证H2在空气中燃烧的产物中是否含有H2O2”的实验装置。试填空:

⑴甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂
是______________ 。 A.淀粉溶液 B.氯化钠溶液 C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明有H2O2产生的实验现象是__________________,冰块的作用是______________________。
⑵乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2产生,写出该反应(高锰酸钾溶液褪色)的离子方程式:___________________。
⑶丙同学对乙同学的检验方案提出质疑;若锌粒中杂质与稀硫酸反应有少量H2S、SO2等气体生成,也会使高锰酸钾溶液褪色,从而导致错误的判断。为消除丙同学的疑虑,请你提出对上述实验装置的改进建议:___________________________
20. (10分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融Al作用而制得,某课外活动小组在实验室内通过下列装置(如下图)制取少量纯净的无水氯化铝。 
⑴开始实验时,不能先点燃A装置的酒精灯后打开分液漏斗的活塞,将浓盐酸注入烧瓶内,其理由是 。
⑵A装置发生反应的化学方程: 。 ⑶在E处可收集到纯净的氯化铝,原因 。 ⑷若无B、C装置,使A产生的气体直接进入D,实验产生的不良后果是 。
⑸F装置的作用是 。
19. (9分)具有如下转化关系的物质A、B、C、D、E有多种组合:

⑴若E是酸性氧化物,且为易挥发的晶体,A、D两气体反应生成淡黄色固体B和水,则E的化学式是__________,A的化学式是_____________________ 。
⑵若A的焰色反应为黄色,C是可用做自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量约是D质量的25.8%,则A的化学式是___________,E物质中含有的化学键有_____________(选填序号:A离子键、B极性共价键、C非极性共价键、D氢键)
⑶若C是水,B是一种烃,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色,且与碳酸氢钠溶液反应放出二氧化碳,则A是______________,D是________________。
18. (12分)氯气泄漏事件在国内外时有发生,常给国家和人民生命财产造成不少损失。如果发生了氯气泄露事件,切忌惊慌,应向上风向地区转移,并用湿毛巾护住口鼻;到了安全地带要好好休息,避免剧烈运动,以免加重心肺负担。氯气是很重要的工业原料,很多化学物质成分中均含有氯,如饮用水消毒常用的消毒剂;三氯化磷是无色液体,是重要的化工原料,可用来制造许多磷的化合物,如敌百虫等多种农药。
科学家舍勒在化学上的另一个重要的贡献是发现了氯气。一般情况下,在实验室中常用较强的氧化剂如MnO2、PbO2、KMnO4、KClO3、Ca(ClO)2等氧化盐酸制氯气。 ⑴写出用PbO2和浓盐酸反应制备氯气时的化学方程式:_____________________,已知PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应时的离子方程式________________________
⑵现用漂粉精和浓盐酸反应制备氯气,将足量漂粉精投入浓盐酸中。反应中涉及到化学方程式可能有__________________________、__________________________。
⑶磷在氯气中燃烧可生成无色液体PCl3和淡黄色晶体PCl5,PCl3还可继续与Cl2作用生成PCl5,PCl3和PCl5均可与水反应:PCl3+3H2O=H3PO3+3HCl, PCl5+H2O=POCl3+2HCl,PCl5+4H2O=H3PO4+5HCl。PCl5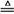 PCl3+Cl2↑。
PCl3+Cl2↑。
①已知PCl3分子为三角锥形结构,键角为100°,H3PO3与足量NaOH溶液作用
的产物是Na2HPO3,则在下列物质的分子中各原子的最外层均达到了八个电子结
构的是___________(填序号)。
A.PCl3 B.PCl5 C.Na2HPO3 D.Na3PO4
②已知PCl5分子为三角双锥形结构的非极性分子(如图所示),

则PCl3F2有_____种同分异构体。
③水在液态时存在H3O+和OH-,液氨中存在少许NH4+和NH2-,PCl5在一定条件
下也存在类似水和氨的解离方式,其中一种离子呈四面体结构,则解离的两种离子
分别是______________和______________。
17. (7分)用37%,密度为1.19 g·cm-3的浓盐酸配制0.1 mol·L-1的稀盐酸500 mL,请回答: ⑴所需浓盐酸的体积为 mL; ⑵此实验配制稀盐酸,除玻璃棒、胶头滴管、试剂瓶外,还需的仪器有 、__________和 。
⑶如果在配制时,第一次加水量太少,搅拌时间较长,对配制溶液的浓度有什么影响? (“偏高”“偏低”或“无影响“)
16. 在反应3BrF3+5H2O=HBrO3+9HF+Br2+O2↑,若有0.3molH2O被氧化,则被水还原的BrF3的物质的量是 A.0.15mol B.0.2mol C.0.3mol D.0.4mol
第Ⅱ卷(非选择题 共86分)
15. 根据相关化学原理,下列判断正确的是 ( )A.若X是原子晶体,Y是分子晶体,则熔点:X<Y B.若A2 + 2D- = 2A- + D2,则氧化性:D2 > A2 C.若R2-和M+的电子层结构相同,则原子序数:R<M D.若金刚石质量为12g,则共价键总数为4NA
14.  在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
(
)
A.HCl
在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
(
)
A.HCl
B.Cl2
C.CO
D.NH3
13. 第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为 ( ) A.CH4·8H2O B.CH4·14H2O C.CH4·(23/3)H2O D.CH4·6H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com