
题目列表(包括答案和解析)
7、下列说法正确的是
A.同周期元素原子的第一电离能从左往右越来越大
B.同族元素原子从上到下第一电离能越来越小
C.同周期元素原子的电负性从左往右越来越大
D.同族元素原子从上到下电负性越来越大
6、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加
氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4] 2+不会与乙醇发生反应
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
5、下列各组原子中,彼此化学性质一定相似的是( )
A. 原子核外电子排布为1S2的X原子与原子核外电子排布为1S22S2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2P能级上只有一个电子对的X原子和3P能级上只有一个电子对的Y原子
D.最外层只有一个电子的X、Y原子
4、下列说法不正确的是( )
A.NH4+的空间构型为正四面体
B.47号元素的电子排布式为:[Kr]4d105S1
C.H-Cl的键能为431.8KJ﹒mol-1,H-I的键能为298.7KJ﹒mol-1 ,这可以说明HCl比HI分子稳定
D.H2O是一种直线型分子
3、设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1.8g铵根离子所含的电子数为1.1NA
B.1mol白磷分子所含共价键数为4NA
C.标准状况下,22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
2、最近的病毒学家研究发现,一氧化氮对“非典”病毒的抑制作用明显。下列关于NO的说法正确的是( )
A.NO是亚硝酸酐 B.NO只能通过人工合成
C.NO可以是某些含低价态氮元素的物质的氧化产物
D.NO与O2按4∶1体积比混合后与足量的水反应可完全转化为硝酸
1、氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A、一个D2O分子所含中子数为8
B.NH3的结构式为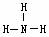
C.HCl的电子式为
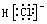 D.热稳定性:HCl>HF
D.热稳定性:HCl>HF
25. (6分)向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物),得到CuSO4·5H2O 250g。
求:⑴混酸中硝酸和硫酸的物质的量之比。
⑵原混合物中Cu和CuO的物质的量之比。
⑶混酸中硫酸的质量分数。
24. (12分)目前工业上主要采用离子交换膜法电解饱和食盐水,制得Cl2和H2,并将电解后所得的Cl2和H2按一定体积比,按图示流程合成质量分数为36.5%的浓盐酸。
H2和Cl2 →合成炉 → 石墨冷凝器 → 一级干燥塔 → 二级干燥塔 → 吸收塔
⑴已知在该生产条件下食盐的溶解度为36.5g,则此时饱和食盐水溶质的质量分数为 ______ 。
⑵若每台电解槽平均每天消耗2.2×104 mol食盐,电解生成的Cl2与H2按体积比1∶1.1 通入合成塔,不考虑各阶段的物料损耗,尾气不再用于合成盐酸。则理论上每天每台电解槽可生产36.5%的盐酸 t。
⑶某厂现有相同的电解槽n台,每台每天消耗食盐a t,氯气与氢气以1∶b (b>1)的体积比通入合成塔,同样不考虑各阶段的物料损耗,则该厂每天可生产36.5%的盐酸_______ t。
23. (7分)长期以来,一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对HFO的研究引起了充分重视。 ⑴HFO的结构式是____________,上述生成HFO的化学方程式是_______________。 ⑵次氟酸与水反应得到溶液A,A中含有B,C两种溶质。B常用于雕刻玻璃,C在MnO2催化作用下能迅速分解生成一种能使带火星木条复燃的气体。次氟酸与水反应的化学方程式为____________________
⑶HFO中O元素的化合价为_______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com