
题目列表(包括答案和解析)
28、在某浓度的NaOH溶液中滴加几滴酚酞试液,溶液立即呈红色,再向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题:
(1)产生该现象的原因可能有:
①
②
(2)简述怎样用实验证明红色褪去的原因是①或者是②:
27、已知X元素的原子K层比M层多1个电子,Y元素的原子最外层电子数比内层电子总数少3个,Z元素原子最外层电子排布式为3sn3pn-1。
(1)这三种元素的元素符号是:X_________Y_________Z_________
(2)X、Y所形成的化合物的电子式____________________。
(3)检验某化合物是否含有X元素所采用的实验方法称为
_____________________。
(4)Y和Z形成的化合物的化学式____________。实验测得,当此化合物在液态或固态时不导电,溶于水时能导电,由此判断该化合物具有
____________键。
26、某些金属氧化物跟熔融烧碱反应可生成盐。一些单质及其化合物的相互转化关系如下图。根据以下框图填空:
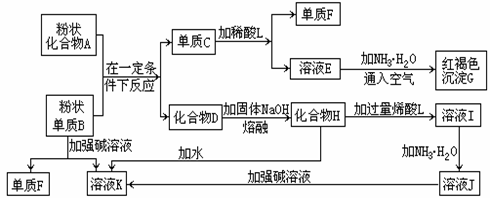
(1)单质F是 _____ (填化学式)。
(2)写出由E生成G的离子反应方程式 。
(3)溶液I中所含金属阳离子是 。
(4)稀酸L若改用浓酸,则不能选用的浓酸是 。
25、人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。
(1)目前中学课本中的酸碱理论是1887年阿仑尼乌斯提出的电离理论。试用电离方程式表示氨的水溶液呈弱碱性的原因
_________________________________________ 。
(2)1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子理论。凡是能够释放质子(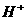 )的任何含氢原子的分子或离子都是酸;凡是能与质子(
)的任何含氢原子的分子或离子都是酸;凡是能与质子(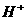 )结合的分子或离子都是碱。按质子理论,下列粒子在水中既可看作酸又可看作碱的是
(填写序号)。
)结合的分子或离子都是碱。按质子理论,下列粒子在水中既可看作酸又可看作碱的是
(填写序号)。
A、CH3COO- B、NH3 C、H2O D、HSO3- E、OH- F、NO3-
(3)1923年路易斯提出了广义的酸碱理论。凡是能给出电子对用来形成化学键的物质都是碱;凡是能和电子对结合的物质都是酸。因此酸又称为电子对接受体,碱是电子对的给予体。
试指出下列两个反应中的酸或碱:
①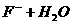

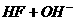 ,该反应中的碱是 _____ (填“
,该反应中的碱是 _____ (填“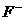 ”或“
”或“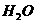 ”)。②
”)。②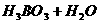

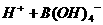 ,该反应中的酸是 ___
(填“
,该反应中的酸是 ___
(填“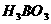 ”或“
”或“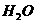 ”)
”)
24、t℃时,将3摩尔A和1摩尔B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写:
xC(g),2min时反应时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________。
(2)X=_________________
(3)该反应化学平衡常数表达式为K=___________________________。
(4)若继续向原平衡混合物的容器中通入少量氦气后,化学平衡[ ]
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
23、智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)配平该反应的化学方程式,并用短线标出电子转移方向及总数。
NaIO3 + NaHSO3 → NaHSO4 + Na2SO4 + I2 + H2O
(2)已知含氧酸盐的氧化作用随着溶液酸性的增强而增强。在制备实验时,
定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段,
反应速率呈递增趋势,可能的原因 __________
________________________________________________________________
反应进行一段时间后,反应速率又呈递减趋势,可能的原因
是 __________________________________ 。
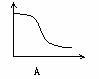
22、下列各图中,纵坐标表示能量,横坐标表示反应过程,均从反应物开始,则表示正反应是吸热反应的是[ ]
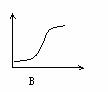
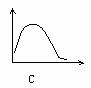

第Ⅱ卷(共84分)
21、用NA表示阿伏加德罗常数,下列叙述正确的是[ ]
A、常温常压下,16gO2和O3的混合物所含分子数为0.5NA
B、1mol CH3+(碳正离子)中含有电子数为8NA
C、常温常压下,31g白磷与红磷混合物,含有NA个磷原子
D、1L 0.1mol·L-1的FeCl3溶液中含Fe3+为0.1NA
20、已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是[ ]
A.3 Cl2 + 6 FeI2 →2FeCl3 + 4 FeI3 B.Cl2 + FeI2 →FeCl2 + I2
C.Co2O3 + 6 HCl →2CoCl2 + Cl2↑+ 3H2O
D.2Fe3+ + 2I- →2Fe2+ + I2
19、A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是[ ]
A、X、Y、Z的稳定性逐渐减弱
B、A、B、C、D只能形成5种单质
C、X、Y、Z三种化合物的熔沸点逐渐升高
D、自然界中存在多种由A、B、C、D四种元素组成的化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com