
题目列表(包括答案和解析)
3.下列说法错误的是
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
2.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的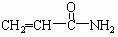 (丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:
(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:
①能使酸性KMnO4溶液褪色 ②能发生加聚反应生成高分子化合物
③只有4种同分异构体 ④能与氢气发生加成反应
其中正确的是
A.①②③ B.②③④ C.①③④ D.①②④
1.保护环境是每一个公民的责任。下列做法:
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理
③推广使用一次性木质筷子 ④推广使用清洁能源
⑤过量使用化肥、农药 ⑥推广使用无氟冰箱。
其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
25.(12分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g);反应达到平衡后,再恢复至原温度。
2C(g);反应达到平衡后,再恢复至原温度。
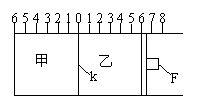 回答下列问题:
回答下列问题:
(1)可根据
现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号:① <6 ② >6 ③ =6)。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 (填:6、7、8);若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 (填:4、5、6)。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量的关系是
(填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
24.(8分)铬位于元素周期表中第四周期第ⅥB族,其主要化合价为+6、+3、+2、O,其中+3价较为稳定。+3价的铬在水溶液中以水合离子的形式存在(如[Cr(H2O)6]3+,但常常简写为Cr3+ ,Cr3+在水溶液中呈蓝紫色。校化学兴趣小组的同学查阅资料,对铬的化合物进行探究性研究并掌握了一些课堂内学不到的知识和技能。
(1)Cr2O3呈绿色,微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3呈灰蓝色,与Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,则Cr(OH)3电离方程式是:
。
(2)在K2Cr2O7溶液中存在着Cr2O72-与CrO42-,并达到以下平衡:
 Cr2O72-+H2O 2 CrO42-+2H+
Cr2O72-+H2O 2 CrO42-+2H+
(橙红色) (黄色)
试填空:向K2Cr2O7溶液中加入适量的NaOH溶液时,溶液呈 色;当加入浓盐酸时,溶液呈 色。
(3)在试管中加入3mL硫酸酸化的K2Cr2O7溶液,然后向其中滴加乙醇,观察到橙红色褪去,变为蓝紫色,并产生酸味物质。请写出该过程的离子方程式: 。
23.(10分)原子数相同、电子总数也相同的不同粒子,互称为等电子体。等电子体的结构相似、物理性质相近。HN3称为叠氮酸,N3-也被称为类卤离子。
试回答下列问题:
⑴N3-与CO( 或NO)分子互为等电子体,N3-的空间构型是 直 线型
HN3为[N= (填“极性分子”或“非极性分子”)。
⑵酸性:HN3 < __HX (卤化氢) (填“>”或“<”);
热稳定性:HN3_< _HX (填“>”或“<”)。
⑶HN3与硝酸银溶液作用,可得一种不溶于水的白色固体,该固体加热时,会发生爆炸产生两种含不同类型化学键的物质。试写出该白色固体加热爆炸的化学方程式 N__。
⑷叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质;叠氮酸钠也可用于汽车保护气囊中。3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A。请写出该反应的化学方程式 3NaN aN +4N↑____ 。
22.(8分) 对于可逆反应:mA(g)+nB(g) ⇌ pC(g)+qD(g),当在一定温度下达到平衡时,可以得出平衡常数K: 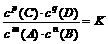 平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大。
平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大。
下面A、B、C、D四张图是用计算机制作的在密闭容器、不同条件下进行的反应:
 X ⇌ Y;的进程图解。图中的纵坐标表示X和Y的物质的量的分数(物质的量的百分数);横坐标表示时间:分(以分为单位的反应进程)。图中的“ ”是X,“ ”是Y。
X ⇌ Y;的进程图解。图中的纵坐标表示X和Y的物质的量的分数(物质的量的百分数);横坐标表示时间:分(以分为单位的反应进程)。图中的“ ”是X,“ ”是Y。
A 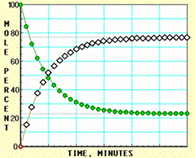 B
B 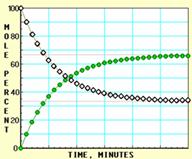
C 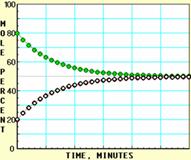 D
D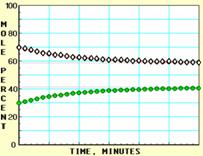
K值大小与温度的关系是:温度升高,K值___ __ ____(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。平衡常数K最小的图是 ;(用A、B、C、D回答,下同)平衡常数K最大的图是 ;平衡常数K=1的图是 。
21.(10分)科学家预测“氢能”将是未来最理想的新能源。
根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
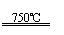
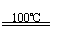
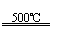
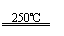 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
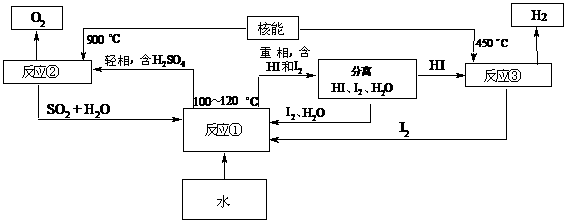 请写出反应①、②、③的化学方程式:反应① 反应② 反应③
请写出反应①、②、③的化学方程式:反应① 反应② 反应③
用硫-碘热循环法制取氢最大的优点是 。
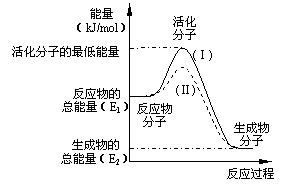
20.(10分) 在化学反应中,只有极少数能量比
平均能量高得多的反应物分子发生
有合适取向的碰撞时才可能发生化学反应,
这些分子被称为活化分子。
使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察左图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =__________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+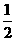 O2(g) = H2O(g) ;△H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) ;△H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
19. (8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第
周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为
(填“高”或“低”)熔点 (填“固”、“液”或“气”)体,
(填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第
周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为
(填“高”或“低”)熔点 (填“固”、“液”或“气”)体,
(填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com