
题目列表(包括答案和解析)
58.5 143.5
y 12.26 g
求得:y=5g
m (Na2CO3)=100-x-y=100-42-5=53 g。
w
(Na2CO3)= ×100%=53%,
×100%=53%,
w
(NaHCO3)=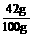 ×100%=42%,
×100%=42%,
w (NaCl)=1-53%-42%=5%。
答案: 混合物中NaHCO3的质量分数为42%,
Na2CO3的质量分数为53%,
NaCl的质量分数为5%。
 例题2-2-3
例题2-2-3
200℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6 g,求原混合物中CO2和H2O的质量比。
 解析与答案
解析与答案
本题涉及Na2O2与CO2和H2O的两个反应,且两个反应中均生成O2,所以11.6 g的混合气体与Na2O2反应后固体只增重了3.6 g,其差量11.6 g-3.6 g=8 g为生成的O2的质量。
设: CO2和H2O的质量分别为x、y,则
2CO2 + 2Na2O2=2Na2CO3 + O2↑
2×44 32
x
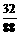 x
x
2H2O + 2Na2O2=4NaOH + O2↑
2×18 32
y
 y
y
依题意,得: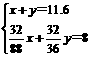
求得: x=4.4g,y=7.2g,
x∶y=4.4∶7.2=11∶18。
答案:原混合物中CO2和H2O的质量比为11∶18。
 例题2-2-4
例题2-2-4
2. 钠的化合物
钠的化合物
 例题2-2-1
例题2-2-1
将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应,所得氢氧化钠溶液的溶质质量分数为
50%,试写出过氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少?
 解析与答案
解析与答案
本题解题关键是对所得NaOH溶液的溶质质量分数50%的分析,可以有两种理解:
(1) 根据溶质质量分数的概念进行计算:
w(NaOH)= ×100%
×100%
(2) 根据所生成溶液中溶质和溶剂的质量相等进行计算.
解:发生的反应为:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
设混合物中含Na2O2和Na2O质量分别为x,y。
2Na2O2+2H2O=4NaOH+O2↑;
2×78 2×18 4×40 32
x  x
x  x
x 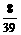 x
x
Na2O+H2O=2NaOH
62 18 2×40
y  y
y  y
y
[解法一]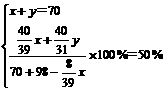
[解法二]
解得:x=39g; y=31g。
答案: ①2Na2O2+2H2O=4NaOH+O2↑;
②原混合物中含Na2O2 39 g,Na2O 31g。
 例题2-2-2
例题2-2-2
今有Na2CO3、NaHCO3和NaCl的混合物100g,加热到质量不再减少为止,剩余残渣为84.5g,将残渣溶于水,滴入足量AgNO3溶液得到白色沉淀,加足量稀HNO3后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
 解析与答案
解析与答案
要计算Na2CO3、NaHCO3和NaCl的质量分数,必须求出它们在100 g混合物中各自的质量。从条件分析,这三种物质加热,只有NaHCO3受热分解,而Na2CO3、NaCl不分解,加热后剩余残渣为84.5g,减少的质量是NaHCO3加热分解跑走的CO2和H2O的质量,以此为突破口求出NaHCO3的质量;然后滴加AgNO3溶液,再加足量稀HNO3,剩余沉淀为12.26g是AgCl的质量,根据方程式再求出NaCl的质量,最后求出Na2CO3的质量。
|
2NaHCO3=Na2CO3+H2O↑+CO2↑ 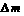
2×84 18 44 62
x 100 g-84.5 g=15.5 g
求得:x=42g。
NaCl + AgNO3=NaNO3 + AgCl↓
6.2 m(Na) m(NaOH)
m(Na)=4.6g m(NaOH)=8g
∴ 未被氧化的Na为4.6g,被氧化成氧化钠的金属Na为4.6g, 溶液中溶质的质量分数为:
w(NaOH)= 100%=14.5%
100%=14.5%
3. 依数值列算式求解
本题涉及反应: Na2O+H2O=2NaOH
2Na+2H2O=2NaOH+H2↑
4Na+O2=2Na2O
解题思路:
由H2的质量 求出金属Na质量
求出金属Na质量 求出Na2O质量
求出Na2O质量 被氧化的Na的质量
被氧化的Na的质量


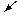
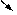 生成NaOH质量
生成NaOH质量
生成NaOH质量
生成NaOH质量
总NaOH质量
答案 2Na + 2H2O=2NaOH + H2↑
2 23 2
23 2 40 2
40 2
m(Na) m(NaOH) 0.2g
m(Na)=4.6g, m(NaOH)=8g
m(Na2O)=10.8g-4.6g=6.2g
∵ 4Na+O2=2Na2O
Na2O+H2O=2NaOH

 存在: Na2O 2Na 2NaOH
存在: Na2O 2Na 2NaOH
62 2 23
2
23
2 40
40
2. 找出物质间的量的关系
1. 确定所发生的反应
3.反应后所得溶液中溶质的质量分数。
 解析与答案
解析与答案
解析:解好有关化学方程式的计算题的关键应从下面3点出发:
2.被氧化成氧化钠的金属的质量是多少克?
1.未被氧化的金属钠的质量是多少克?
1. 钠
钠
 例题2-1-1
例题2-1-1
把一小块金属钠暴露在空气中,观察到以下现象:
①金属钠表面逐渐变暗;
②过一段时间以后又逐渐变潮湿;
③再过些时候又变成白色固体;
④又过一段时间白色固体变成白色粉末。
试写出以上发生的各种现象的有关方程式。
 解析与答案
解析与答案
金属钠为活泼金属,极易被空气中的氧气氧化生成氧化钠,所以表面逐渐变暗且无光泽;氧化钠在空气中溶于水,表面变潮湿而生成氢氧化钠;氢氧化钠和空气中的二氧化碳和水蒸气反应,生成碳酸钠晶体,即含有10个结晶水的碳酸钠;再过一段时间,含有结晶水的晶体风化失水而变成粉末状物质。
答案: ①4Na+O2=2Na2O;
②Na2O+H2O=2NaOH;
|
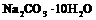 ;
;
④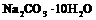 =Na2CO3+10H2O。
=Na2CO3+10H2O。
 例题2-1-2
例题2-1-2
将一定质量的钠投入到12.3g t℃H2O中,得到t℃时的NaOH饱和溶液15.6 g。试计算:①该温度
下NaOH溶液的溶解度是多少? ②反应掉Na的质量是多少克?
 解析与答案
解析与答案
此题未给出实际参加反应的Na的质量,有一定的难度,最好的方法就是差量法求出生成的NaOH的质量,反应掉水的质量,继而求出溶解度。
设:反应掉Na、H2O的质量为x、y,生成NaOH的质量为z,
2Na + 2H2O = 2NaOH + H2↑ 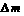
2×23 2×18 2×40 44
x y z 15.6-12.3=3.3
列式,求得x=3.45g,y=2.7g,z=6g
所以S(NaOH)=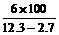 =62.5g
=62.5g
答案:①该温度下NaOH的溶解度为62.5 g;
②反应掉3.45 g Na。
 例题2-1-3
例题2-1-3
取一支大试管,加入15mL的水与苯( ),静置。取黄豆大的金属钠(
),静置。取黄豆大的金属钠( Na=
Na= ),轻轻放入这支装有水和苯的试管,试推测能观察到的实验现象是____________________。
),轻轻放入这支装有水和苯的试管,试推测能观察到的实验现象是____________________。
 解析与答案
解析与答案
因为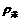 <
< <
< ,所以当将Na块轻轻放入这支装有水和苯的试管时,钠刚好落在界面上。又由于Na与水反应有H2产生,H2又使Na块上浮,当附着在Na块表面的H2逸出后,Na块又下沉到界面上,又发生反应,重复发生上述现象直至钠块反应耗尽,逐渐消失。
,所以当将Na块轻轻放入这支装有水和苯的试管时,钠刚好落在界面上。又由于Na与水反应有H2产生,H2又使Na块上浮,当附着在Na块表面的H2逸出后,Na块又下沉到界面上,又发生反应,重复发生上述现象直至钠块反应耗尽,逐渐消失。
答案:钠块在苯和苯、水的界面上下起伏,并有气泡产生。

 例题2-1-4
例题2-1-4
为防止药品变质,实验室通常采用密封的方法保存药品。少量的金属钠是放在盛有煤油的广口试剂瓶中,而不是直接放在密封的广口瓶中。
(1) 请解释原因;
(2) 若金属钠直接露置在空气中,有下列现象:a. 变成白色粉末 b. 变暗 c. 变成白色固体 d. 固体表面变潮湿,上述现象出现的先后顺序是_____。
 解析与答案
解析与答案
本题是利用钠的性质,解决实际问题。

|

|
|

|
2Na + O2 ==Na2O2
2Na + S=Na2S
与化合物 2Na + 2H2O=2NaOH + H2↑
2Na + 2HCl=2NaCl + H2↑
分析:Na有强还原性,可直接与空气中的O2和H2O反应,因此在保存少量钠时,必须禁止Na直接与空气接触。
若直接放在空广口瓶中,Na也可以与瓶内空气中的O2和少量水蒸气反应。而放在煤油中,因Na的密度大于煤油,且不与煤油反应,所以沉在煤油下面,通过煤油与空气隔绝。
若Na露置在空气中,发生的主要变化为:





|
 Na2O
Na2O NaOH
NaOH Na2CO
Na2CO 10H2O
10H2O Na2CO3
Na2CO3
银白色 变暗 潮解吸水 白色固体 白色粉末状
通过反应,推断现象。
答案 (1) 钠的密度大于煤油,沉在煤油下面,且钠不与煤油反应,所以通过煤油,将钠与空气和水隔绝。少量的钠放在空瓶中,即使是密封瓶中也含有氧气,钠会与氧气反应而变质。
(2) b、d、c、a
 例题2-1-5
例题2-1-5
 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: ①钠的物理性质;
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: ①钠的物理性质;
②钠与水反应的产物是什么。
(1)当进行适当操作时还需要的仪器有____________。
(2)如何进行操作?_______________。
 解析与答案
解析与答案
(1) 由于实验目的是做钠和水的反应,验证钠的物理性质并验证钠和水反应的产物是什么,所以要收集产生的气体, 并验证气体的可燃性。
(2) 要由钠和水反应来验证钠的物理性质,使自由的钠块与水接触,就要想办法将钠块放入水中。
答案 (1) 还需要小试管和酒精灯。
(2) 将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇 指堵住试管口移近酒精灯,松开拇指点燃试管中的气体。
 例题2-1-6
例题2-1-6
将4.6g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热,反应后生成的固体是( )
A.黄色固体混合物 B.氧化钠与硫化钠
C.硫与硫化钠 D.过氧化钠与硫化钠
|
 解析与答案
解析与答案
本题容易错认为只发生:2Na+S==Na2S这个反应,而并未注意条件中: ①钠是过量的;②未隔绝空气对反应物进行加热。全面考虑后,在加热条件下,钠既能与硫化合生成Na2S,也能与空气中的氧气反应生成Na2O2,钠又是过量的,故生成物是Na2O2和Na2S的混合物。
答案 D
 例题2-1-7
例题2-1-7
有一块表面被氧化成氧化钠的金属钠,质量是10.8g。将它投入到100g水中完全反应后,收集到0.2g氢气,试计算。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com