
题目列表(包括答案和解析)
8.在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是
A.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
B.c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C.c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-)
D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
7. t℃时,水的离子积为 Kw,该温度下将a mol·L-1,一元酸HA与 b mol·L-1一元碱 BOH等体积混合,要使混合液呈中性,必要的条件是
A.混合液的pH=7
B.混合液中,[H+]=
C.a=b
D.混合液中,c(B+)=c(A-)+c(OH-)
6.醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)= c(CH3COO-)+c(OH-)
C.c(H+) = c(OH-)-c(CH3COOH)
D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
5.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10ºC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
4.下列说法中,不正确的是
A.室温下,CH3COOH分子可以存在于pH=8的碱性溶液中
B.在0.1mol•L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+不可能大量存在
D.在NaAlO2溶液中,HCO3-不可能大量存在
3.用物质的量都是0.1mol的CH3COOH和CH3COONa混合后配成1L溶液,已知溶液中的c(CH3COO-)>c(Na+),下列关系正确的是
A.c(H+)<c(OH-)
B.c(CH3COOH)>c(CH3COO-)
C.c(CH3COO-)+c(OH-)=0.1mol•L-1
D.c(CH3COOH)+c(CH3COO-)=0.2mol•L-1
2.PH=5的H2SO4溶液稀释500倍后,溶液中c(H+):c(SO42-)约为
A.1:2 B.1:5 C.1:10 D.10:1
1.常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2mol•L-1的盐酸与0.1mol•L-1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是
A.a>b=c B.a>c>b C.c>b>a D.b>c>a
2.20 g y x
x=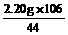 =5.30 g y=
=5.30 g y=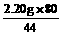 =4.00 g
=4.00 g
剩余固体NaOH的质量为:6.00 g-5.30 g=0.70 g
所以两种组成的质量分数分别为:
w
(Na2CO3)=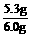 ×100%=88%
×100%=88%
w (NaOH)=100%-88%=12%
NaOH溶液的质量分数为: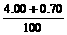 ×100%=4.7%
×100%=4.7%
答案: (1) 第一份的固体组成:w (Na2CO3)=77%,w (NaHCO3)=23%;第二份固体组成w (Na2CO3) =88%,w (NaOH)=12%
(2) 第一份NaOH溶液的质量分数为3.5%,第二份NaOH溶液的质量分数为4.7%
 例题2-23
例题2-23
 如图2-7所示,用来验证绿色植物进行光合作用的实验装置,先将这个装置放在暗室里24 h,然后移到阳光下;瓶子内盛有NaOH溶液,瓶口密封。
如图2-7所示,用来验证绿色植物进行光合作用的实验装置,先将这个装置放在暗室里24 h,然后移到阳光下;瓶子内盛有NaOH溶液,瓶口密封。
(1)经过相当长的一段时间以后,摘下植物的叶片,经过处理后加碘液数滴而叶片颜色无变化,证明液片中__________,说明了__________。
(2)瓶内放NaOH的作用是_____;将绿色植物放置24 h的作用是_____________。
(3)若瓶内析出m g白色沉淀,说明_____,发生反应的化学方程式为__________,将此沉淀加热,可得到多少克CO2气体?
 解析与答案
解析与答案
叶片经处理后加碘液不变色,说明叶片中无淀粉。淀粉遇碘变蓝,这是淀粉的特性。
此时淀粉已被消耗,考虑光合作用的暗反应过程,CO2固定和还原均需要酶参与催化,这个过程消耗了淀粉。
|
2NaHCO3=Na2CO3+CO2↑+H2O。
答案: (1) 无淀粉; CO2是光合作用的原料。
(2) 吸收CO2;消耗植物体内原有淀粉。
|
2NaHCO3=Na2CO3+H2O+CO2↑
2×84 44
m g x
x=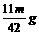
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com