
题目列表(包括答案和解析)
13(8分).(05年南京三模)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是____________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是_____ __ __ __ __ __ __ _______(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是_________ __。
14.(18分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
10.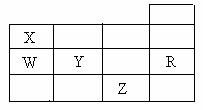 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
11(应届).下列说法中正确的是 ( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子 D.最外层有5个电子的原子都是非金属原子
11(历届).(05年全国卷II理综)下列说法正确的是 ( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
12(应届).下列物质性质变化规律正确的是 ( )
A.金属Na、Mg、Al的硬度依次降低 B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低 D.O、F、H的原子半径依次减小
12(历届).下列说法中正确的是 ( )
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
9. A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是①n+2
②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是 ( )
A.①④ B.②⑧ C.③⑤ D.⑥⑦
8.下列物质中,含极性键和非极性键且分子有极性的是 ( )
A.乙烯 B.乙醛 C.甲醇 D.三氯甲烷
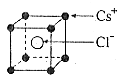
7.已知CsCl晶体的密度为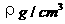 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个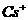 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
(
)
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
(
)
 A.
A. 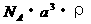 B.
B.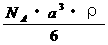
C. 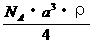 D.
D.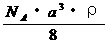
5. X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② D.②④ C.②⑤⑥ D.①②③④
6(应届)。下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.PCl5 C.HCl D.CF2Cl2
6(历届).下列说法中正确的是 ( )
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B.P4和CH4都是正四面体分子且键角都为109o28ˊ;
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个;
D.由原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度。
4.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是 ( )
A. A、B、D不可能在同周期 B.D一定在第二周期
C.A、D可能在同一主族 D.C和D的单质可能化合为离子化合物
3.下列物质的电子式书写正确的是 ( )
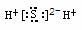 A.NaCl
A.NaCl 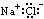 B.H2S
B.H2S
C.-CH3  D.NH4I
D.NH4I 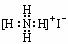
1(应届). 1919年,科学家第一次实现了人类多年的梦想--人工转变元素。这个核反应如下: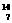 N+
N+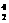 He→
He→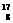 O+
O+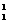 H下列叙述正确的是
( )
H下列叙述正确的是
( )
A. O原子核内有9个质子
B.
O原子核内有9个质子
B. H原子核内有1个中子
H原子核内有1个中子
C.O2和O3互为同位素 D.通常情况下,He和N2化学性质都很稳定
1(历届).最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.下列化合物中,既有离子键,又有共价键的是 ( )
A.CaO B.SiO2 C.H2O D.Na2O2
29、I、(5分).烧过菜的铁锅未及时洗净(残液中含NaCl),第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失水的产物)。试用有关电极反应式、离子方程式和化学方程式表示Fe(OH)3的生成过程。
(1)负极:_______________________;
(2)正极:_______________________;
(3)离子方程式:_________________;
(4)化学方程式:_________________;
(5)总方程式:___________________。
Ⅱ(7分)、将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

|
金属 |
电子流动方向 |
电压(V) |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
已知:构成两电极的金属活泼性相差越大,电压表的读数越大。
请依据表中数据判断:
(1)______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)金属。其对应的原电池的电极反应式为:
负极____________________________,正极______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com