
题目列表(包括答案和解析)
18.NaCl晶体中最小重复单元(晶胞)如右图所示。已知:氯化钠的摩尔质量为M g/mol,某一定条件下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为bg/cm3。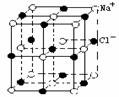 则下列叙述正确的是
则下列叙述正确的是
A.每个Na+周围最近且等距离的Cl-所围成的空间构型为正六面体
B.每个Na+周围最近且等距离的Cl-所围成的空间构型为正八面体
C.阿伏加德罗常数NA可表示为M/2a3b
D.阿伏加德罗常数NA可表示为4M/a3b
17.下列关系正确的是
A.离子半径: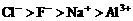 B.热稳定性:
B.热稳定性: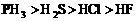
C.结合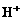 能力:
能力: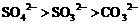 D.熔点:石英>食盐>冰>干冰
D.熔点:石英>食盐>冰>干冰
16.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难
溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,反应前后SO42-的浓度基本不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(H2O)4] 2+
C.向反应后的溶液加入乙醇将析出CuSO4·5H2O晶体
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
15.已知A、B元素同周期,且电负性A<B,下列说法正确的是
A.A与B形成化合物时,A显正价,B显负价且A原子的半径大于B原子的半径
B.第一电离能不可能B小于A
C.最高价含氧酸的酸性:A对应的酸性弱于B对应的酸性
D.气态氢化物的稳定性:HmB小于HmA
14.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
13.下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是
A. BeCl2 B. PCl3 C. N2 D.光气(COCl2)
12.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后两极共生成气体18.5g,体积为33.6L(标况),在生成的气体中,重氢(D)和普通氢(H)的原子数比为
A、1:2 B、2:3 C、1:3 D、2:5
11、下列说法中正确的是
A、含有非极性键的化合物分子一定是非极性分子
B、原子晶体中一定存在共价键
C、等质量的水和冰体积不相同的原因与水分子之间的氢键有关
D、若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
10.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它比一个普通H2分子多一个氢原子核 D.它的组成可用H3表示
9.已知硼化物BxHy 2-与B10C2H12的电子总数相同,则BxHy 2-的正确表达式为
A. B9H152- B. B10H14 2- C. B11H132- D. B12H122-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com