
题目列表(包括答案和解析)
28.(10分)纯碱中常含有少量的NaCl杂质,利用下图的仪器装置可用来测定纯碱Na2CO3
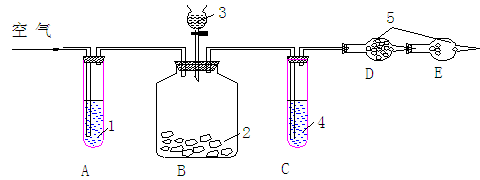 的百分含量:供选用的试剂有:纯碱样品、碱石灰、浓盐酸、浓H2SO4、NaOH溶液,稀硫酸,自来水、无水CaCl2、饱和NaHCO3溶液。
的百分含量:供选用的试剂有:纯碱样品、碱石灰、浓盐酸、浓H2SO4、NaOH溶液,稀硫酸,自来水、无水CaCl2、饱和NaHCO3溶液。
实验步骤:a按图连接好装置并检查气密性;b准确称量盛有干燥剂的干燥管D的质量(m1g);c准确称取纯碱样品质量(n1g)并放入广口瓶内;d从分液漏斗中缓缓滴试剂3至不再产生气体为止;e缓缓鼓入空气数分钟,然后再称量D的总质量(设为m2g),根据上述实验,回答下列问题:
(1)试剂1、3、4、5分别为1________3_________4__________5________
(2)进行操作e时,要缓缓鼓入空气数分钟,鼓入空气的作用是____ _____。
(3)如果撤去A装置,直接向B中缓缓鼓入空气,则会导致实验结果________
(填 “偏大”、“偏小”或“不变”)。
(4)进行d、e操作时,均要求“缓缓”进行,理由是_______ _________.
。
(5)装置C和E的作用分别是C E 。
(6)根据此实验,计算纯碱中Na2CO3百分含量的数学表达式为:
。
27.(10分)工业上要求空气中的SO2允许含量不得超过0.02mg/L。用针管注射器吸取100mL(标准状况下)某烟道气气样,小心注入有50mL水作吸收剂的锥形瓶中(假定气样中的SO2全部被吸收),加几滴淀粉作指示剂。当用0.0010mol·L-1标准碘液滴定,反应达到终点时,用去2.5mL标准碘液。
试回答:
(1)写出碘与SO2反应的化学方程式__________________________________________。
(2)滴定分析时,使用的滴定管是___________式滴定管(酸、碱)。
(3)滴定终点的标志是_____________________________________。
(4)烟道中SO2的体积分数是________________________.
(5)这种烟道气能否直接向大气排放_________(填:能或不能)。如果不能排放,设计处理这种尾气的方案,写出必要的化学方程式______________________________________________________________________________.
26. (8分)(1)用某种量器对一种液体进行体积计算,设正确读数为nmL,仰视读数为xmL,俯视读数为ymL。若x>n>y,则所用量器是___________
A.量筒 B.酸式滴定管 C.容量瓶 D.碱式滴定管
(2)试管内壁附有下列物质,能用稀盐酸除去的是___________
A.盛石灰水后留下的白色固体
B.用足量H2还原CuO后留下的红色固体
C.氯化铁溶液和氢氧化钠溶液反应后留下的红褐色固体
D.用足量CO还原Fe2O3后留下的黑色固体
(3)中和滴定过程中,下列操作能否使测定结果(待测液的浓度数值)发生偏差,下列情况下使测定结果偏高的是______________(用序号填写)
A.滴定管用蒸馏水润洗后立即用于中和滴定
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或标准溶液滴在锥形瓶外
D.滴定接近终点时,用蒸馏水冲下滴定管尖嘴口的半滴溶液至锥形瓶中
E.滴定前仰视读数而滴定终了俯视读数
25.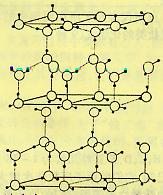 (10分)水分子间存在一种叫“氢键”的作用(介于范德
(10分)水分子间存在一种叫“氢键”的作用(介于范德
华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水
分子被4个水分子包围形成变形的正四面体,通过“氢键相
互连接成庞大的分子晶体一次,其结构示意图如图所示
⑴1mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是
kJ•mol-1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断理由是__________________________________________________________________
24.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。

23.(10分)W、A、Y、Z四种短周期元素的原子序数A>W>Z>Y。W原子最外层电子数不超过最内层电子数。A原子L层电子数是其他各层电子总数的2倍。Y原子形成的气态氢化物分子与形成的最高价氧化物分子的电子数之比为5∶11。Z是自然界中含量最多的元素。
(1)W在周期表中处于第 周期 族。
(2)Y元素可形成化学式为Y60的物质,该物质称为足球烯。已知该物质溶于有机溶剂,熔
点较低,由此可推测Y60晶体属于 晶体,Y原子间形成 键。
(3)Y和Z形成的化合物与W和Z形成的化合物反应,其化学方程式可能是:
; 。
(4)这四种元素原子半径的大小为 > > > (填元素符号)。
22.(10分)推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为______。
⑷某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
21.(12分)
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可反氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
20.由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是
A、A2B3是三氧化铝 B、A3+和B2-最外电子层上的电子数相等
C、A是第二周期第IIIA族的元素 D、B是第三周期第VIA族的元素
第二卷 (非选择题,共80分)
19.下列关于某单烯烃(R-CH =CH2)的说法正确的
A.该烯分子至少有5个σ键,1个π键
B.该烯分子中有2个碳原子都是sp2杂化
C.该烯分子一般不发生水解反应
D.该烯分子中最多有4个原子在同一平面上
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com