
题目列表(包括答案和解析)
29、(11分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O NO + NO2 + 2NaOH 2NaNO2 + H2O;
⑴ 若在标准状况下有NO、NO2的混合物恰好与50mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
⑵ 设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
① NOx与NaOH溶液反应的化学方程式:
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。
26.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。

将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴ 甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵ 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,
装有碱石灰的干燥管的作用是 。
⑶ 戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因(不一定填满)。
① 。
② 。
③ 。
请提出一个能提高准确度的建议(要有可操作性,且操作简单)
。
27(本题包括2小题,共17分)
I、(7分)(06江苏卷20).下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。

⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
 Ⅱ(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1:1,但I晶体中阴、阳离子个数比是2:1,I常用做干燥剂。B还含非极性共价键。
Ⅱ(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1:1,但I晶体中阴、阳离子个数比是2:1,I常用做干燥剂。B还含非极性共价键。
请按要求填空:
(1)G的电子式是 。
(2)反应⑥的化学方程式是 ,反应⑤在空气中发生时的现象是 ,已知C的燃烧热是1300 kJ·mol-1,则表示C烧热的热化学方程式是 。
(3)根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是 。
28 (本题包括2小题,共16分)
I、.(8分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
⑴ 已知酸性FCH2COOH>CH3COOH,试推断:
①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
⑵ 已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:
上述三种银盐在水中溶解度由大到小的顺序__________ ______________。
⑶ 除HF外,其他卤化氢沸点随相对分子质量增大而升高,HF的沸点反常的原因是___
_________________________________________________________。
⑷已知、的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出的结构式_____________________。
Ⅱ(8分)将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化): 2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为____________mol。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A、c(NO)=0.35 mol·L-1或c(NO)=0.09 mol·L-1 B、c(NO2)=0.4 mol·L-1
C、 c(O2)=0.2 mol·L-1或c(NO)=0.4 mol·L-1 D、c(NO2)=0.35 mol·L-1
13、(06北京卷9)将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定).该b L气体中NH3的体积分数是( )
A.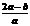 B.
B. C.
C. D.
D. 第Ⅱ卷(非选择题,共60分)
第Ⅱ卷(非选择题,共60分)
12、(06吉林、黑龙江11).下列叙述正确的是:
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D. CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
11、(2006高考化学江苏部分2)氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含2的中子数为8 B.NH3的结构式为
C.HCl的电子式为 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
10、(06四川卷12).25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
H+4)= c(SO2-4) H+4)>c(SO2-4) H+4)<c(SO2-4) D.c(OH-)+c(SO2-4)= c(H+)=c(NH+4)
9、(06重庆卷9)温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤ ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
A. ③①④②⑥⑤ B. ①③⑥④②⑤ C. ③②①⑥④⑤ D. ⑤⑥②④①③
8、(06全国Ⅱ7)将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
7、(06江苏卷8)实验室可用右下图所示装置干燥、收集某气体R,
则R可能是( )
A.S02 B.NH3 C.HCl D.Cl2
6、下列说法,违反科学原理的是
A.为了消除碘缺乏症,可以采用食盐加碘的方法
 B.闪电时,空气中的N2发生的变化可称为氮的固定 C.干冰可用于人工降雨
B.闪电时,空气中的N2发生的变化可称为氮的固定 C.干冰可用于人工降雨
D.在2SO2+O2 2SO3的反应中,使用催化剂可提高SO2的转化率

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com