
题目列表(包括答案和解析)
24].(2005.6上海卷24)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1) 该反应中的还原剂是 。
(2) 该反应中,发生还原反应的过程是 → 。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目________________________。
(4) 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
23].已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O化学计量数a~k均为正整数)。回答下列问题:
(1) 根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)
(2) 根据反应中离子的电荷守恒,可得b、c、d、f的关系式是
(3) 根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
(4) 若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。
22].如图中每一方框中的字母代表一种反应物或生成物。已知A、B、C、D均为前三周期元素的单质,也是中学化学常见的物质。其中A、B为固体,且B是良好的半导体材料;C、D为气体。电解H的饱和溶液生成X、C和D,此反应是一个重要的化工反应。(物质间相互转化时水已略去)
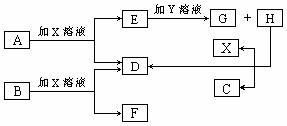
请填空:
(1) 写出下列物质的化学式:A C X 。
(2) B单质为 晶体(填晶体类型)
(3) E和G在水溶液中混合反应的离子方程式为 ________ ;
(4) 25℃时,用石墨电极电解含0.4mol H物质的水溶液,在阳极产生0.1mol气体,测得此时溶液体积为200mL,则此时该溶液的pH约为 。
21]. (2005.6江苏卷17)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A. 1:7 B.1:9 C.1:5 D.2:9
20]. 多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是
A.2 B.3 C.4 D.5
19]. (2005.11启东中学)Cl2通入一定量浓KOH溶液中,完全参与反应后经测定体积分数为a的氯气被氧化。若溶液中含有Cl―、ClO―、ClO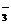 ,且c(Cl―)与c(ClO
,且c(Cl―)与c(ClO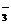 )之比为6:1,则a为
)之比为6:1,则a为
A.0.25 B.0.50 C.0.75 D.0.80
18]. (2005.6江苏卷7)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2
氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3+ +2I―=2Fe2+ +I2
17].用焦炭、水、空气为原料制氨的化学方程式如下:
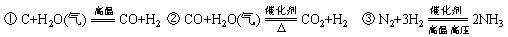
参加反应的焦炭与氨气的物质的量之比是
A. 3︰2 B. 3︰4 C. 2︰3 D. 1︰2
16].(2005.8泗阳中学)在硝酸酸化的条件下,PbO2、NaBiO3、K2S2O8、Na4XeO6均可将Mn2+氧化为MnO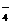 ,有关氧化剂则被还原为Pb2+、Bi3+、SO
,有关氧化剂则被还原为Pb2+、Bi3+、SO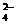 、Xe。若制得等物质的量的MnO
、Xe。若制得等物质的量的MnO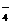 ,消耗氧化剂物质的量最少的是
,消耗氧化剂物质的量最少的是
A.NaBiO3 B.Na4XeO6 C.K2S2O8 D.PbO2
15].在一定条件下,还原性:Cl-<Br-<Fe2+<I-<SO2,由此判断下列反应必然发生的是:
①2Fe3++SO2+2H2O=2Fe2++SO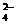 +4H+ ②I2+SO2+2H2O=4H++SO
+4H+ ②I2+SO2+2H2O=4H++SO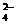 +2I-
+2I-
③2Fe2++I2=2Fe3++2I-
④2Br-+4H++SO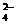 =SO2↑+Br2+2H2O
=SO2↑+Br2+2H2O
A.①② B.②③ C.③④ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com