
题目列表(包括答案和解析)
4、下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A. H3O+、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
3、下列哪一事实可以肯定某物质是碱( )
A. 能与酸反应,生成盐和水 B. 其水溶液中,有金属阳离子和OH-离子
C. 其水溶液能使酚酞溶液变成红色 D. 其水溶液中的阴离子只有OH-离子
2、对某物质进行试验:①能与碱反应生成盐和水 ②该物质的水溶液能与铁反应生成氢气 ③该物质的水溶液中阳离子只有H+,据你学过的酸的概念,下列判断正确的是( )
A. ①②③均能说明该物质是酸 B. ①②③均不能说明该物质是酸
C. 只有③能说明该物质是酸 D. ②③能说明该物质是酸
1、某化合物M在固态时不导电,但熔化或溶于水中能完全电离。下列关于M的说法中正确的是( )
A. M为非电解质 B. M是金属
C. M是离子晶体 D. M为弱电解质
24.(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂。工业上制得的Na2S2O3·5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30.00mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。(Na2S2O3+H2SO4 = Na2SO4+SO2↑+S↓+H2O)测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
7.540 |
15.08 |
35.00 |
|
二氧化硫的体积/L |
0.672 |
1.344 |
2.688 |
|
硫的质量/g |
0.8000 |
1.600 |
3.200 |
(摩尔质量:Na2S2O3·5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度。
(2)分析以上实验数据,该样品中 (填写选项字母)
A.仅含有Na2S2O3·5H2O
B.含有Na2S2O3·5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3·5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)。
23、(8分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5 g (相当于钙元素600 mg),成人每天服用1片。”
(1)“1.5 g碳酸钙与600 mg的钙”的计量关系是如何得出来的,请列式并计算表示。
(2) 该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下实验:取10片该片剂碾碎后放入足量的HCl中经充分反应(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1 L溶液,取其20.0 mL,然后用0.0500 mol/LKMnO4 溶液滴定,反应中用去12 .0 mL KMnO4溶液,发生的离子反应为:2MnO4― +5H2C2O4 +6H+= 2Mn2+ +10CO2↑+8H2O
①请通过计算回答该片剂中碳酸钙的含量。
②参照上述关于“钙尔奇D600片剂”的文字说明,你认为该片剂的名称应该叫“钙尔奇D 片剂”。
22.(12分)已知次氯酸能跟烯烃发生加成反应:
RCH=CH2+HOCl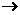 R
R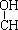 CH2Cl(或R
CH2Cl(或R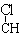 CH2OH)
CH2OH)
某烯烃能发生如下所示的转化:
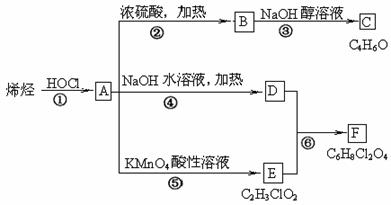
试回答下列问题:
(1)写出结构简式A ,C ;
(2)从结构上分析,可与A互为同分异构体的结构简式有: 、 。
(3)上述反应中属于加成反应的是 、属于消去反应的是 (填反应序号)。
(4)写出反应④的化学方程式: ________________ 。
21.(8分)A为某芳香烃的衍生物,只含C、H、O三种元素,环上有两个取代基。又已知A的相对分子质量为150,A不能使FeCl3溶液显色,但可被新制Cu(OH)2氧化为B,B能浓硫酸存在和加热时,发生分子内的酯化反应生成C,C分子中有一个含氧的六元环。
(1)写出符合上述条件的B的可能的结构式:___________________________
(2)写出任意一种B生成的C的结构简式:___________________________
(3)含有苯环的属于酸的A的同分异构体的有 种
20.(12分)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
(1)江苏省大气污染特征是________________
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出江苏省防治酸雨的两条主要措施
。
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是
________________________________________________________________________。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是_________________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
 HCHO+H2SO3→
HCHO+H2SO3→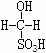
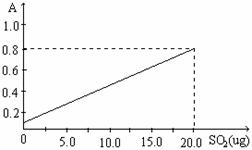
该反应类型属于___________________。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为 。
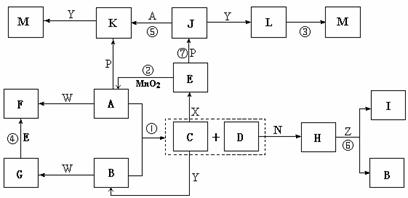
19.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)写出C的电子式 ,I的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com