
题目列表(包括答案和解析)
9.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸 B.两溶液的体积相同,酸是弱酸
C.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
8.常温下用惰性电极电解1L足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变)
A.pH=n B.pH=-lg n C.pH=14-lgn D.pH=lgn+14
7.NA表示阿伏加德罗常数,下列说法中正确的是
A.3.6 g重水中所含质子数为2NA B.4.48 L N2所含分子数为0.2 NA
C.12g金刚石中含有碳碳键的个数为2NA
D.1 molS与足量Cu反应生成Cu2S转移NA个电子
6.温度相同、浓度均为0.2 mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤ ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑥⑤ B. ①③⑥④②⑤
C. ③②①⑥④⑤ D. ⑤⑥②④①③
5.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH+4、Cu2+、Cl-、NO-3 B.K+、Na+、SO2-3、S2-
C.K+、Na+、AlO-2、SO2-4 D.Ba2+、Fe2+、NO-3、Br-
4.下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极
2.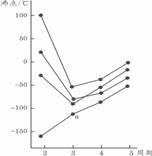 右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl C.PH3 D.SiH4 3.下列有关叙述正确的是
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
 B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反 应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的强
1.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
28.自然界存在的某天然碱(纯净物)的化学组成可表示为:aNa2CO3·bNaHCO3·cH2O(a.b.c为正整数)。若取3.32g天然碱样品与300℃加热分解至完全(300℃时Na2CO3 不分解),产生CO2112ml(标准状况)和水0.45g,试通过计算确定该天然碱的化学式。
27.已知 (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。

试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________;b.能发生水解反应______________________;
(2)A分子中的官能团的名称是______ _______;
(3)A→C 的反应类型是_____________,E→F的反应类型是___________;
A 氧化反应 B 还原反应 C 加成反应 D 取代反应
(4)写出化学方程式:A→B_________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:___________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com