
题目列表(包括答案和解析)
8. 在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铜、硫酸铝和硫酸铁溶液,这种试剂是( )
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
7. 下列化合物中,前者比后者粒子半径小的是( )
A.r(Na)、r(Al) B.r(Be)、r(Mg) C.r(S2-)、r(K+) D.r(Cl-)、r(Cl)
6. 下列化学式既能表示物质的组成,又能表示物质分子式的是( )
A.NH4Cl B.SiO2 C.H2O2 D.Cu
5. 下列分子中所有原子都满足最外层8电子结构的是( )
A.次氯酸 B.二氧化碳 C.三氟化硼 D.五氯化磷
4. 既可与盐酸反应得到气体,又可与氢氧化钠溶液反应得到气体,且两种情况下得到的气体各不相同的是 ( )
A. NH4HS B.NH4Cl C.NaHCO3 D.Al
3. 下列离子方程式中,正确的是( )
A.实验室用氯化铵和氢氧化钙制氨气 NH4+ +OH ˉ=NH3↑+H2O
B.碳酸氢钙溶液跟稀硝酸反应 Ca(HCO3)2 +2H+=Ca2+ + 2H2O + 2CO2↑
C.向氢氧化钠溶液中加入少量氯化铝溶液 Al3++3OH ˉ=Al(OH)3↓
D.往碳酸氢钠溶液中加硫酸氢钠溶液 HCO3 ˉ+H+= H2O+CO2↑
2. 设NA代表阿佛加德罗常数,下列说法正确的是( )
A.22.4L N2中所含的分子数为NA
B.15.6g Na2O2与足量水反应,转移的电子数为0.4NA
C.500mL 浓度为0.1mol/L pH为3的醋酸溶液中H+数目为0.05NA
D.56gN2与CO的混合气体中原子数为4NA
1. 据《华夏时报》报道,2006年2月17日上午10点左右,在北京朝阳安贞里小区内,一口电缆井内产生的沼气(主要成分是甲烷)被井中电缆短路产生的火花突然引爆,将停在电缆井上方的一辆福特嘉年华轿车炸得腾空而起,几近报废。下列关于甲烷的说法中,不正确的是( )
A.甲烷分子是非极性分子
B.甲烷分子中碳原子位于由四个氢原子形成的正方形的中心
C.甲烷是所有烃分子中,含氢的质量分数最大的一种
D.与NH3、H2O、HF相比,甲烷的熔沸点最低
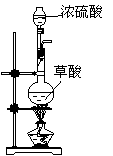
21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此设计如下实验方案:
|
序号 |
A |
B |
C |
D |
E |
|
仪器及药品 |
 |
 |
 |
 |
 |
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:H2C2O4 CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作第一步应是 ;最后一步应是
熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用
是 。
第二步 :将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
22(10分)、工业上用饱和食盐水作原料,用电解方法制取烧碱。 (1)写出电极反应和总化学方程式:阳极______________________,阴极_________________________;总反应________________________。 (2)NaOH在_________极附近生成; (3)电极材料为石墨和铁网,阳极必须用_________,原因是
___________________________________________; (4)电解过程中可能发生的副反应有两个,它们是: ______________________________________,
(5)若将电解槽内的隔膜去掉,同时升高电解液的温度,此时电解产物间发生反应:NaOH+Cl2→NaClO3+NaC1+H2O(未配平),假设反应进行完全,则在该条件下最后得到的两种产物的物质的量之比是______________
(6)若在NaClO3溶液中加入固体KCl,则可得到重要工业产品KClO3晶体,其原因是_______________________________________________。
23(10分)、如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去) 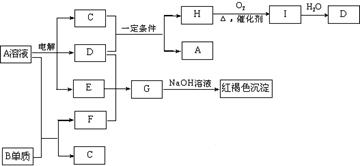 请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
(1)V= L(用含x的代数式表示)。
(2)当x= 时,V的值最水,其值为 L。
(3)当V=2.016L时,第一次加热所得固体的质量为 g。
20、 甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
A、A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B、B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物
质的量浓度相等
C、将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的
乙比析出的甲多
D、若乙中含有少量的甲,可用重结晶的方法提纯乙
第І卷 (非选择题,共40分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com