
题目列表(包括答案和解析)
5.设NA为阿伏加德罗常数,下列叙述正确的是
A.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
B.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数为0.2 NA
C.1L0.1mol·L-1的醋酸溶液中的分子总数大于0.1NA
D.通过化学反应制得1molO2,转移电子的数目一定是4NA
4.为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法可以提高燃料的燃烧效率的是
A.将煤转化成煤气或转化为甲醇等液体燃料来燃烧
B.将煤脱硫后燃烧
C.通入大大过量的空气
D.将煤干馏成煤焦油来燃烧
3.根据表中给出的几种物质在常压下的熔、沸点数据,判断下列有关说法中错误的是
|
|
NaCl |
AlCl3 |
SiCl4 |
单质B |
|
熔点 |
810℃ |
190℃ |
-68℃ |
1300℃ |
|
沸点 |
1465℃ |
183℃ |
57℃ |
2500℃ |
A.SiCl4形成的晶体是分子晶体 B.单质B可能是原子晶体
C.电解NaCl水溶液可制得金属钠 D.不能用电解熔融AlCl3制取单质铝
2.已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-。若在某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是
A. Br- B. Cl- C. OH- D. S2-
1.下列说法正确的是
A.钢铁发生电化腐蚀的正极反应式:Fe-2e-== Fe2+
B.氢氧燃料电池的负极反应式:O2 +2H2O +4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-==Cl2↑
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
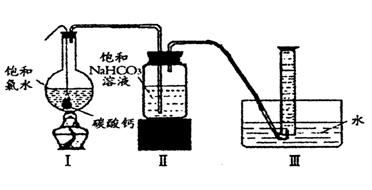
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现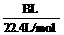 明显小于
明显小于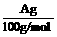 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
;
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________ _
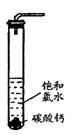 ①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因
(2)写出步骤③中第一份及第三份滤液发生的离子方程式:
第一份:
第三份:
(3)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ __ ___;
21. (8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B、C和E均为2.0摩,设D为x摩、F为y摩.当x、y在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:
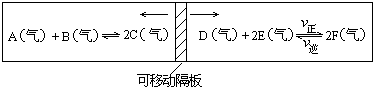
1) 若x=1、y=3,反应 (填A.正向进行 B逆向进行C已达平衡状态)。其理由是 。
2)
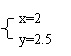
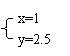 若
与
, 则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填A相等、B不相等或C不能确定).其理由是:
若
与
, 则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填A相等、B不相等或C不能确定).其理由是:
。
20.
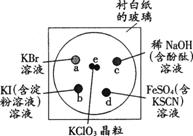 (15分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
(15分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述反应的现象,并写出相应的化学方程式。
e处:
a处:
b处:
c处:
d处:
19. (15分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:

1) H是 (A 极性分子 B 非极性分子)F的电子式: 。
2) 反应①的离子方程式: 。
3) 实验室检验M中含的阴离子的方法是:
|
座位号 |
|
|
|
|
。
4) 每生成0.1molK,反应放出9.83KJ热量,该反应的热化学方程式为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com