
题目列表(包括答案和解析)
25.中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰,它是水和二氧化碳的吸收剂”。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计的实验方案如下
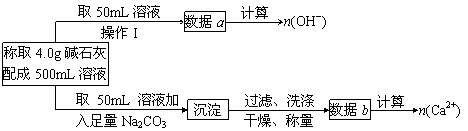

①下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是_________(填序号)
A.n(Na+)+2n(Ca2+)= n(OH-)
B.2n(Na+)+n(Ca2+)=n(OH-)
C.n(Na+)+n(Ca2+)=2n(OH-)
②现有4.0g碱石灰,设其中n(Na+)=x mol,n(Ca2+)=y mol,请填写列空格:
|
碱石灰的可能组成 |
NaOH,CaO |
NaOH,CaO,Ca(OH)2 |
NaOH Ca(OH)2 |
NaOH, Ca(OH)2,H2O |
|
x、y之间关系式(等式或不等式) |
A |
40x+56y<4.0<40x+74y |
B |
C |
把表中A、B、C的关系式填在下面空格上:
A: ;B: ;C:
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。
24.(共8分)
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,化学方程式:
KI+O3+H2O→KOH+I2+O2(未配平)
(1)该反应中氧化剂的名称为 ,还原产物的化学式为
(2)配平后的化学方程式是
(3)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为
23.(共10分)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
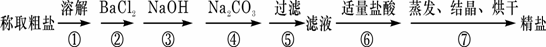
 (1)判断BaCl2已过量的方法是
(1)判断BaCl2已过量的方法是
(2)第④步中,相关的离子方程式是
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是____________________________
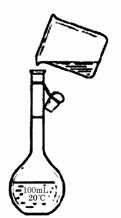
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是
。
22.(共6分)
盐W的饱和溶液在电解时的产物能发生如下图所示的系列变化。图中每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已经略去)。已知:A、B、C、D、E在常温常压下均是气态物质,A的水溶液pH大于7,W的饱和溶液pH小于7,反应①属于置换反应。
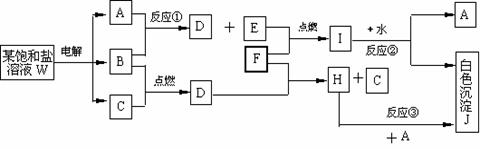
回答下列问题:
(1)A的电子式为
(2)反应②的化学方程式
(3)反应③的离子方程式
21.(共15分)
物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
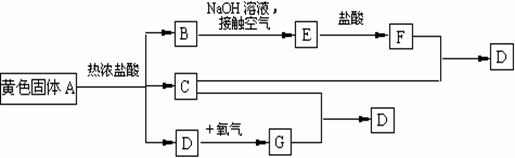
(1)A是 ,C是 ,F是 (均填化学式)。
(2)A与热盐酸反应的离子方程式为
(3)写出该框图中由B→E的化学方程式
20.(9分)
如图所示的是以黄铁矿为主要原料接触法制硫酸工业流程示意图。回答下列问题:
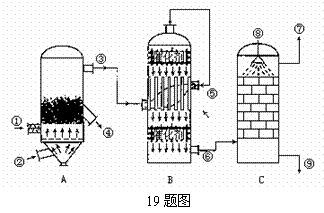

(1)从出口⑥处排出的气体一般不应含有 (填序号)
A.SO3 B.N2 C.SO2 D.水蒸气
(2)对从进口⑧喷进的液体的叙述最准确的是 (填序号)
A.水 B.发烟硫酸 C.98.3%的浓硫酸 D.稀硫酸
(3)设备A中发生反应的化学方程式为
19.(共6分)
已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示:
|
|
a |
b |
c |
d |
e |
|
c |
↓ |
↓ |
╱ |
↑ |
- |
|
b |
↓ |
╱ |
↓ |
- |
- |
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“╱”表示实验未做。
则c 是 e是 (均填化学式)
18.(共10分)
铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与四氧化三铁发生铝热反应的化学方程式为
(2)铝与氢氧化钾溶液反应的离子方程式是
(3)工业品氢氧化钾的溶液中含有某些含氧酸盐杂质,可用离子交换膜法电解提纯。
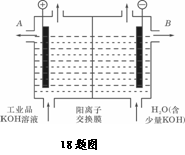 电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是____________________ 。
②通电开始后,阴极附近溶液pH会增大,其主要原因是 (填序号)
A.阳极区的OH-移向阴极所致
B.阴极产生的金属钾与水反应生成了大量OH-
C.阴极由H2O电离出的H+放电成H2,水电离平衡移动使OH-浓度增大
③除去杂质后的氢氧化钾溶液从溶液出口_____________(填写“A”或“B”)导出。
17.(共8分)
下列实验操作或对实验事实的叙述正确的是 (填序号)
①为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
③使用胶头滴管的任何实验都不允许将滴管插入液面以下;
④为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用石英坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
⑧用洁净的玻璃棒蘸取浓HNO3,点在pH试纸中部以测定此浓HNO3的pH。
16. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体有可能使湿润的淀粉KI试纸最终仍呈白色
D.实验②证明Fe2+既有氧化性又有还原性
第Ⅱ卷(非选择题,共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com