
题目列表(包括答案和解析)
20.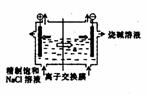 (9分)目前世界上比较先进的电解制碱技术是离子交换膜法,右图为离子交换膜法电解饱和食盐水的原理示意图。
(9分)目前世界上比较先进的电解制碱技术是离子交换膜法,右图为离子交换膜法电解饱和食盐水的原理示意图。
(1)透过交换膜的离子a是____________,电解饱和食盐水的离子方程式是______ ________。
 (2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的性质--允许阳离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它允许阴离子通过,阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4溶液,通电电解,阴极的电极反应式为_____________________________________,在III区得到_________________________________。
(2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的性质--允许阳离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它允许阴离子通过,阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4溶液,通电电解,阴极的电极反应式为_____________________________________,在III区得到_________________________________。
(3)在(2)的装置基础上撤去离子交换膜A、B,且把Na2SO4溶液换成CuSO4溶液,通电一段时间后,若要恢复到电解前溶液的pH和体积,需向所得溶液中加入0.1molCu(OH)2,则此电解过程中转移电子的物质的量为_________。
19.(8分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
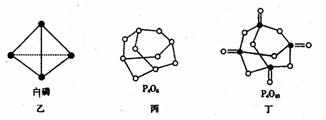
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982 kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
17.(8分)工业生产硫酸的原料气成分(体积分数)为SO2:7%,O2:11%,N2:82%.压强及温度对SO2转化率的影响如下:
 压强/MPa 压强/MPa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是______________________________________________。
(2)分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是_________________________________________________。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105kJ能量。若反应:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_______kJ能量。(不考虑其他过程释放的能量)
2SO3(g);△H=-196.6kJ·mol-1放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_______kJ能量。(不考虑其他过程释放的能量)
(4)依据题给数据计算:在500℃、0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(O2):V(N2)=_________:82(结果保留两位有效数字)。
16、(11分)下面是某化学学习小组的同学进行“草酸晶体受热分解的部分产物的验证”的研究性实验,已知草酸及草酸晶体的一些相关知识如下表:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
密度(g·cm-3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。且分解产物中的气体可能是CO、CO2或它们的混合物。请回答下列问题:
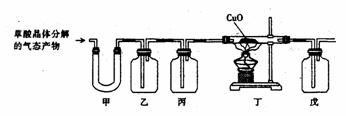
(1)写出草酸晶体加热分解的化学方程式:__________________________。
(2)填写表中空格:(请在澄清石灰水、氢氧化钠溶液、浓硫酸,无水硫酸铜之间选择试剂)
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
甲 |
|
验证分解产物有水生成 |
|
乙 |
|
除去产物中的CO2 |
|
丙 |
浓硫酸 |
|
|
戊 |
|
验证CO氧化产物是CO2 |
(3)在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性(如下图)。请回答下列问题:
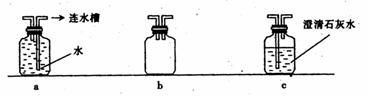
①为证明通往玻璃管的CO气体已除去CO2,可在乙和丙之间连接_______。(填装置序号)
②在装置丁和戊之间连接b装置,其作用是______________________。
③为了防止余气对实验室或环境造成污染,可在装置丁后连接________(填装置序号)。
(4)资料记载:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。若在乙装置中盛澄清石灰水,发现澄清石灰水变浑浊,能否证明草酸晶体分解生成的气体中一定有CO2,请说明由_____________________________。
15、(6分)某工厂的废水只含硫酸镁和少量硫酸,课外活动小组以此作为课题,探讨如何从中回收纯净的硫酸镁固体。他们设计了两种不同的方案,请你参加讨论:
(1)方案一:选用镁粉作试剂。
1往废水中逐渐加入镁粉,当观察到 时,说明加入镁粉的量已经足够。
2接下来的操作方法依次是 和蒸发。
(2)方案二:选用氢氧化钠溶液作试剂。
1向废水中逐滴加入氢氧化钠溶液,当 时,停止滴入氢氧化钠溶液。
2为了得到纯净的硫酸镁溶液,接着应进行的实验操作是过滤、洗涤沉淀。其中洗涤沉淀的操作是_________________________
3往洗涤过的沉淀中加入硫酸到沉淀恰好完全溶解时停止滴加,蒸发溶剂得到硫酸镁固体。
(3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同?
;原因是 。
14.已知t℃时,盐M(不含结晶水,摩尔质量为126g·mol-1)的溶解度为S g。在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液,饱和溶液的密度是ρg·ML-1,物质的量浓度是c mol·L-1,质量分数为ω。若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入b g M·7H2O,下列等式不正确的是( )
A.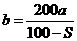 B.
B.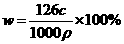 C.
C.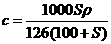 D.b=2a
D.b=2a
第II卷(共58分)
13.下列图像是NaCl、CsCl、干冰的晶体结构图或是从其中分割出来的部分结构图,试判断属于NaCl的晶体结构图像的是( )
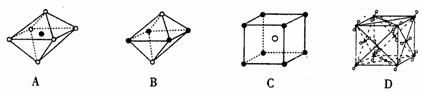
12.将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:

B.分散系的分类:
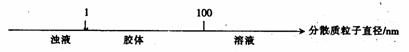
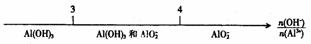
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
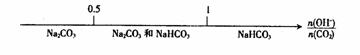
D.CO2与NaOH溶液反应后的产物
11.下列离子方程式中不正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++NH4++SO42-==BaSO4↓+H2O+NH3·H2O
B.碳酸氢钠溶液与硫酸氢钠反应:HCO3-+H+==CO2↑+H2O
C.向AlCl3溶液中滴加少量NaAlO2溶液:Al3++3AlO2-+6H2O==4Al(OH)3↓
D.漂白粉配制成的溶液中通入SO2: Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com