
题目列表(包括答案和解析)
9、在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为
A、0.4mol/(L·s) B、0.3mol/(L·s) C、0.2mol/(L·s) D、0.1mol/(L·s)
8.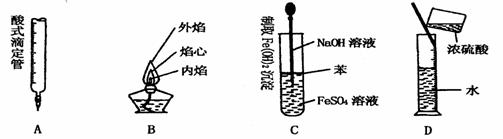 下列对实验仪器名称的标注或实验操作,正确的是
下列对实验仪器名称的标注或实验操作,正确的是
7、用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等的是
|
|
A |
B |
C |
D |
|
甲 池 |
HCl(aq) |
CuCl2(aq) |
NaOH(aq) |
H2SO4(aq) |
|
乙 池 |
NaCl(aq) |
K2SO4(aq) |
CuSO4(aq) |
AgNO3(aq) |
6、向反应器充入1mol N2和3mol H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的
2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的
A 76% B.92% C.88% D. .94%
5.背景材料:①去年12月,我省北江因某企业超标排放含镉的污水,水体受到严重污染;②镉(元素符号Cd)和锌是同主族元素,在自然界中镉与锌、铅共生;③镉化合物中的硫化镉属低毒类;④专家表示“不能治一个污染有造成另一个污染”,在用药选择上,放弃了投放硫化钠的方案,使用了对人没有危害的无机高分子絮凝剂聚合硫酸铁,根据以上材料,下列说法中正确的是
A、镉是ⅡA族元素 B、污染物镉离子的符号是Cd3+
C、硫化镉和氢氧化镉都几乎不溶于水
D、治疗的两种方案都是使污染物与药剂发生氧化还原反应而除去
4、在盛有饱和Na2CO3溶液的烧杯中,插入惰性电极,保持温度不变,通电一定的时间后,下列判断正确的是
A.溶液的pH将增大 B.Na+数和CO32-数的比值将变小 C.溶液浓度不变,有晶体析出 D.溶液浓度逐渐增大并有晶体析出
3、下列说法正确的是
A.分别由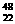 Tl 和
Tl 和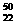 Tl组成的金属钛的单质互称为同素异形体
Tl组成的金属钛的单质互称为同素异形体
B.20g氖含有6.02×1023个原子
C.用铁跟稀硫酸反应制氢气加入少量CuSO4可防止反应过快
D.把16.0g无水硫酸铜粉末投进足量饱和硫酸铜溶液中会析出25.0g晶体
2、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.此项工作可以用来改变分子的某些物理性质
D.此工作可广泛应用于光电器件、生物技术等方面
1.下列说法正确的是
.. A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
21.(8分)现有含NH3为1.7mg·L-1的废水300m3(密度为1g·cm-3),可采用如下两种方法进行处理。
(1)方法一:把甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3 === NO3- + H+ + H2O, 6NO3- + 6H+ + 5CH3OH→ 3N2↑ + 5CO3↑ + 13H2O.
若用此方法处理,假设每步的转化率为100%,需要甲醇多少克?
(2)方法二:对废水进行加热蒸发(假设NH3全部蒸发出来),所得NH3用一定量空气氧化(设空气中氧气的体积分数为20%,氮气的体积分数为80%),发生的主要反应有:
4NH3 + 5O2 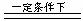 4NO + 6H2O , 4NO + 3O2
+ 2H2O === 4HNO3,
4NO + 6H2O , 4NO + 3O2
+ 2H2O === 4HNO3,
副反应有:4NH3 + 3O2 === 2N2 + 6H2O.产生的混合物的组成为:NO27mol, O218mol, N2225mol和少量的HNO3(高温下NO和O2不反应),求NH3转化为NO和HNO3的转化率各是多少。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com