
题目列表(包括答案和解析)
1.下列关于生产生活中的化学问题的叙述不正确的是
A.为了保护臭氧层,禁止人们使用或少用氟氯代烃
B.在含硫的燃料中加入适量的生石灰,可减少污染大气的二氧化硫的生成
C.食用植物油的主要成分是高级不饱和脂肪酸的甘油酯,是人体内不可缺少的重要营养物质
D.市场销售的洗涤灵的主要成分是对十二烷基苯磺酸钠,它能洗去餐具上的油污,发生的主要是化学变化
25.(10分)有人在古玩市场买了个元宝,专家鉴定认为是由铜和银的合金制造的,为了测出该合金中银的质量分数,专家将30.0g该合金溶于80mL 13.5 mol/L的浓硝酸中,合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1.0mol/L。假设反应后溶液体积不变,试计算:(1)被还原硝酸的物质的量。 (2)合金中银的质量分数。
24. (9分)一含有两种阳离子和一种阴离子的结晶水合物,现称取两份质量均为1.96g的该结晶水合物,配制成溶液。一份加入10mL0.1mol/L KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。另一份加入足量的Ba(OH)2溶液,生成白色沉淀,随即沉淀转变为灰绿色,最后变为红褐色;加热该混合物,逸出气体能无色酚酞试液变红;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。请回答以下问题:
⑴该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
⑵试通过计算确定结晶水合物的化学式。
23.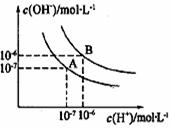 (10分)水是极弱的电解质其可以发生微弱的电离, 纯水
(10分)水是极弱的电解质其可以发生微弱的电离, 纯水
的电离平衡曲线如图所示:
⑴曲线A和B对应的温度不同,其中温度高的为 ,
在B点的纯水的PH= 呈 性
⑵曲线A对应温度下, 1 mol/L NaB溶液的pH = 9,则该溶液中各离子的物质的量浓度由大到小的顺序为 。
⑶曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH =5,结合必要的化学用语解释pH = 5的原因:
。
⑷曲线B对应温度下,若1体积的某强酸和10体积的某强碱混合后溶液显中性,则混合前强酸的pH(pH酸)和强碱的pH(pH碱)的关系为 。
22.(8分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: Ba2+、H+、Na+、NH4+、CO32-、NO3-、OH-、SO42-将这4种溶液分别标记为A、B、C、D进行如下实验:
①在A或D中滴入C,均有沉淀生成
②A和B反应生成的气体能被D吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)A的化学式是 ,判断的理由是
(2)写出其余几种物质的化学式:B C D
(3)写出实验②中有关反应的离子方程式 。
21.(10分)我们知道自然界中的蜘蛛丝和细菌纤维素纤维是典型的纳米纤维。较细的蜘蛛丝直径还不足100纳米,是真正的天然纳米纤维。美国与加拿大的科学家合作,采用蜘蛛基因,利用仿生结构,成功地纺制出人造蜘蛛丝,其强韧性能优于钢材。
(1)纳米纺织材料凭借其内部所特有的小尺寸效应、表面效应等日益受到广大消费者的
喜爱。许多纳米材料的粒子直径都在1-100nm之间,从分散系的角度看应该属于
(2) 纳米是长度单位,物质的颗粒达到纳米级时,具有不同的性质,如果单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,下列对“纳米铜”的说法正确的是: (填序号)
A.“纳米铜”与铜片还原性相同 B.“纳米铜”比铜片更易失电子
C.“纳米铜”比铜片的氧化性强
(3)钢铁在人们生活中应用非常广泛,但是钢铁因腐蚀造成的损失全球每年高达7000亿美元,目前钢铁被腐蚀的主要形式是吸氧腐蚀,其正极发生 反应,负极发生的电极反应式为 。为了减少这种腐蚀生产生活中常见的有哪些防腐措施: 。(至少填两种措施)
20.(10分)已知A为常见金属,在空气中燃烧发出耀眼的白光,X、Y为常见非金属,X、E、F、G常温常压下为气体,C为液体,B是一种盐,受热易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现在A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。
请填写下列空白:
(1) 反应④为在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(2) 反应②的化学方程式为
(3) 从D溶液制备D的无水晶体的“操作a”为
(4) 工业上常利用电解熔融D的无水晶体来制取A,而不用电解熔融A的氧化物来制取A,简述理由
(5) 为了较准确测定G气体的相对分子质量,对测定条件有何要求
19.(9分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A单质是自然界中密度最小的气体,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体可以和氢氧化钠反应放出无色刺激性气味气体E。请回答下列问题:
(1) 写出B单质的电子式 ;C和D形成淡黄色固体化合物电子式 。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为 其水溶液
显 性,用离子方程式说明 。
(3) E分子的空间构型是 ,属于 分子(填极性或非极性)
(4) A、B、C三种元素还可以形成另一种化合物,其热的浓溶液可以溶解铝和铁,但常
情况下它的浓溶液又可盛放在铝或铁制的容器中,原因是
。
18.(14分)钠和氯气反应可以在下面的试验装置中完成,将新切取并用滤纸吸去煤油的一小块钠,放入具支试管中,然后按照图组装好,
加热金属钠,到钠熔化成光亮的球状时,立即
 通入氯气,并停止加热,此时可看到钠剧烈燃
通入氯气,并停止加热,此时可看到钠剧烈燃
烧并生成大量白烟,片刻,试管内壁各处都附
着一层白色固体。请完成下面问题:
⑴停止加热,反应仍能继续进行,说明该反应是 反应。(填放热或吸热)
⑵有时熔融的钠跟氯气接触时会产生黑烟,这是因为 。
⑶具支试管的支管应通到10%的NaOH溶液中,防止 。
⑷钠刚熔化时就要通入氯气,如果熔化前通氯气或熔化后还不通氯气都会影响实验效果,为什么 。
⑸通入氯气的量不要太多以免 但也不能太少,以免 。
(6)有同学想证明白色固体就是NaCl,应补充什么实验来说明
。
17.(6分)下列操作或说法合理的是
A.用10毫升的量筒量取4.80毫升的浓硫酸
B.金属钠着火,用泡沫灭火器扑灭
C.用胶头滴管向试管滴液体时,滴管尖端与试管内壁一般不应接触
D.用盐酸可以清洗长期存放过石灰水的试剂瓶
E. 配制FeCl3溶液时,向溶液中加入少量Fe和稀硫酸
F.用已知浓度的酸滴定未知浓度的碱时,碱式滴定管用蒸馏水洗后,未用待测液润洗会导致测量的浓度偏低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com