
题目列表(包括答案和解析)
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B.用液氢替代汽油
C.开发风能 D.开发地热
25.(10分) 在t℃时,向盛有500 g水的烧杯中加入3.7 g Ca(OH)2粉末,充分搅拌。已知t℃时,Ca(OH)2的溶解度是0.185 g。并假设在溶解和反应过程中溶液的体积温度基本保持不变,所得溶液的密度约为1.00g/cm3。试计算下列问题(计算结果保留2位小数)。
(1)求烧杯中所得的石灰水中OH-离子的物质的量浓度。
(2)若采用向上述烧杯中通入CO2气体的方法,使溶液中的Ca2+离子浓度等于0.01 mol·L-1,则需要向烧杯中通入标准状况下CO2 的体积是多少?
24.(8分) 能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
22.(8分) 将2molI2(g)和1molH2置于某2L密闭容器中,在一定温度下发生反应:
 I2(g)+H2(g)
I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示。
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示。
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
21.(10分) 将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
 问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
|
序号 |
实际生产中采取的措施 |
工业生产实例(写名称) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
问题3:化学反应中均伴随着能量的变化。如果一个化学
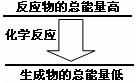 反应中,反应物的总能量和生成物的总能量有如图所示的
反应中,反应物的总能量和生成物的总能量有如图所示的
关系,则该反应过程中的能量变化是 。
已知热化学方程式为:
C(g) + O2(g)= CO2 (g) △H= -393.5KJ/mol
H2 (g) + 1/2O2 (g)= H2O (l) △H= -285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
问题4:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2=2Na2O 2Na+O2 Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
反应的原理不同: 。
20.(10分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为: Cu+HNO3=Cu(NO3)2+NO↑+NO2↑+H2O(未配平)
(1)硝酸在该反应中的作用是 ,该反应的还原产物是 。
(2)0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是 ,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 ,若用排水法收集这些气体,可得标准状况下的气体体积 。
(3)如果参加反应的Cu和HNO3的物质的量之比是5:14,写出并配平该反应的离子方程式_______________________________________________。
(4) 如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是 。
19.(8分) A、B、C、D四种元素都是短周期元素。A元素的离子焰色反应时火焰呈黄色。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构最外层电子数是次外层电子数的三倍。根据上述条件,回答:
(1)C元素在元素周期表中的位置是 ,它的最高价氧化物的化学式为 。
(2)C与B元素形成化合物的晶体类型是______________。
(3)A与D形成稳定化合物的电子式为______________,判断该化合物在空气是否变质的简易方法是 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
18.(12分) 利用如图所示的装置和其他必要的仪器用品,完成下列实验。
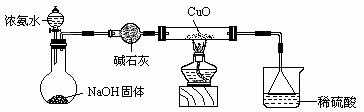
(1)证明氨气具有还原性。已知2NH3+3CuO===N2+3Cu+3H2O。
① 碱石灰的作用是 稀硫酸的作用是 。
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③ 证明NH3具有还原性的实验现象是
。
(2)用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2•6H2O。
在烧杯中的溶液中加入稀H2SO4调节溶液至酸性;加入适量的硫酸亚铁浓溶液后,搅拌。为分离出硫酸亚铁铵晶体,还需要进行的实验操作是:
。
17.(10分) 乙二酸(HOOC-COOH)俗称草酸,在生产和科学实验中有广泛的用途。
(1)测定某未知浓度的KMnO4溶液,可用草酸作还原剂,估计需用0.50mol/L的草酸溶液90mL。则用草酸晶体(H2C2O4·2H2O)配制溶液时,所用的定量玻璃仪器是
(注明仪器规格);如果在定容时视线偏高,则所测得KMnO4溶液的浓度将
(填“偏大”、“偏小”或“不变”)。滴定时的反应原理可简单表示为:
H2C2O4+ MnO4- → CO2↑+ Mn2+
则滴定终点时的颜色变化为: 。
(2)乙二酸其主要物理常数如下:
|
名称 |
分子式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
分解温度 |
|
乙二酸 |
H2C2O4 |
无色固体 |
8.6(20℃) |
182.0 |
175℃ |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
-- |
101.1 |
―― |
 右图是教材上的一个实验装置图,观察装置判断
右图是教材上的一个实验装置图,观察装置判断
进行该实验的目的是 ,
根据上述材料提供的信息,请指出该实验装置的
不合理之处,说明理由。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com