
题目列表(包括答案和解析)
2、下列实验操作中错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
1、据报道,某些建筑材料会产生放射性同位素氡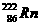 ,从而对人体产生伤害。该同位素原子的中子数和质子数之差是
,从而对人体产生伤害。该同位素原子的中子数和质子数之差是
A.136 B.50 C.86 D.222
28.(10分)一块由Na、Al、Si组成的合金投入水中充分反应后得到一澄清透明溶液A,向其中逐滴加入1mol/L的盐酸,当加入100mL时尚无明显变化发生,但若继续滴入此盐酸,溶液中开始出现沉淀,共向该溶液A中滴入700mL该盐酸时得到了质量不再变化的沉淀(即如果再加入酸,沉淀质量不增加也不减少),过滤、洗涤并灼烧沉淀,最终称得质量为6g。求合金的总质量为多少克?
姓名___ , 班级___ , 分数___ ,
27. (6分)将一定量的氧化铜加入到100.0ml2.5mol/L 的稀硫酸中,待其完全溶解后,再向蓝色溶液中加入19.6g铁粉,经搅拌、过滤、洗涤、干燥等操作,最后得到的固体质量为18.5g 。
①通过计算说明干燥后得到的固体是什么物质?
②求原氧化铜的质量
26.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色
的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请
回答下列问题:
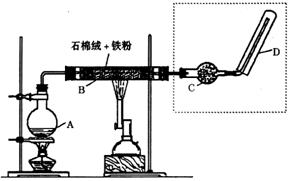

(1)B中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气
体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间
之后,必须进行 操作,方可关闭K2、打开K3,再收集气体。当收集到半
瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法
是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
25.(12分)实验室临时需要用NaOH溶液和C02来制取纯Na2C03溶液。已知C02在通
入NaOH溶液过程中极易过量生成NaHC03,且无明显现象。实验室有下列试剂:①
未知浓度的NaOH;②37%的盐酸;③37%的硫酸;④14%的盐酸;⑤大理石
⑥K2C03固体;⑦Cu2(OH)2C03。
实验室有下列仪器:铁架台;启普发生器;量筒;烧杯;橡皮管;玻璃导管;分液漏斗。
|
Na2C03 |
NaHC03 |
NaCl |
Na2S04 |
NaHS04 |
NaOH |
|
15.9 |
8.4 |
35 |
35.5 |
20 |
40 |
(1)本实验选用的仪器,除启普发生器、橡皮管、玻璃导管外,还需要_________
(2)为保证制得的Na2C03溶液尽量纯,应选用的药品除①外,还需要 (填编号)。
(3)简要叙述直到制得纯Na2C03溶液的实验步骤(仪器安装可省略)。
① ;
② ;
③ 。
(4)根据给出的溶解度数据,若保证在配制过程中不析出晶体,所用NaOH溶液所含
NaOH的质量分数的最大值是 。
24.(12分)无水氯化铝是白色晶体,易吸收水分,在178℃升华。装有无水氯化铝的试剂瓶久置潮湿的空气中会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气流与熔融金属铝作用而制得。
某课外兴趣小组在实验室里通过下列装置制取少量纯净的无水氯化铝。
(1)A装置中发生的反应的化学方程式为:___________________________。
(2)在E处可收集到纯净的氯化铝,其原因是____________________。
 (3)从A装置导出的气体若不 经过 B 、C装置而直接进入 D管,将对实验产生的不良后果是:_______________________________________________________。
(3)从A装置导出的气体若不 经过 B 、C装置而直接进入 D管,将对实验产生的不良后果是:_______________________________________________________。
(4)F装置所起的作用是________________________________________ 。
(5)在D管内发生反应的化学方程式为:_______________________________。
(6)无水氯化铝在潮湿空气中会产生大量白雾,有关反应的化学方程式为:
________________________________________。
23.(12分)某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_____ 。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
22.(10分)把含有Ca(HCO3)2和Mg(HCO3)2的硬水加热煮沸,生成沉淀为 ,如向这种硬水中加入石灰,使其硬度降低,其离子方程式为________________,____________;如若使用磺化煤,其反应式为___________,__________ ;
21.(6分)有一包固体粉末可能含有Cu2+、Al3+、Mg2+、Cl- 、SO42-、CO32-中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出,②向①溶液中加入Ba(NO3)2溶液,无沉淀生成,再滴入AgNO3溶液,有白色沉淀生成 。③再取少量固体加入适量蒸馏水,搅拌后,固体全部溶解,得到无色透明溶液。④向③的溶液中加入氨水,使溶液呈碱性,有沉淀生成,过滤。向过滤所得沉淀中加入过量的氢氧化钠溶液,沉淀部分溶解。这包固体粉末中一定不含有的离子是______________,肯定含有的离子是__________________,这包固体粉末的组成物质是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com