
题目列表(包括答案和解析)
7、下列叙述中正确的是
A.强电解质溶液的导电能力一定比弱电解质的溶液导电能力强
B.因为醋酸是弱电解质,盐酸是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗NaOH比中和盐酸消耗NaOH少
C.强电解质一定是离子化合物,弱电解质一定是共价化合物
D.强电解质是易溶化合物,弱电解质是难溶化合物
E.SO3溶于水后导电性很强,所以SO3是强电解质
F.溶液中电离出的离子与未电离的分子共同存在的物质是弱电解质
6、草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol•L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) B.c(HC2O4-)+c(C2O42-)=0.1 mol•L-1
C.c(C2O42-)>c(H2C2O4) D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
5、已知NaHCO3水溶液呈弱碱性。下列关于0.1mol/LNaHCO3溶液中有关微粒浓度的大小关系正确的是
A、[Na+]+ [H+]=[HCO3-]+2[CO32-]+[OH-] B、[Na+]+ [H+]=[HCO3-]+ [CO32-]+[OH-]
C、[Na+]=[HCO3-]+ [CO32-]+[H2CO3] D、[Na+]>[HCO3-]>[CO32-]>[H2CO3]
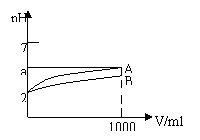
4、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图,下列说法正确的是
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都有是弱酸,则5>a>2
3、酸雨是因为过度燃烧煤和石油制品时,生成硫的氮的氧化物溶于雨水生成硫硫酸和硝酸的缘故。某次酸雨分析数据如下:C(NH4+)=2×10-5mol/L, C(Cl-)=7×10-5mol/L, C(SO42-)=2.8×10-5mol/L C(NO3-)=2.4×10-5mol/L C(Na+)=3×10-5mol/L,据此计算此次酸雨的pH大约为
 A.6
B.5
C.4
D.3
A.6
B.5
C.4
D.3
2、向0.05mol/L的氢硫酸中通入Cl2至H2S刚好被完全氧化,若不考虑溶液体积变化,反应后溶液的pH为
A.2 + lg5 B.2 - lg5 C.1 D.2
1、将pH=5的H2SO4溶液稀释500倍,稀释溶液后的,C(H+)与C(SO42-)的比值近似为
A.1:1 B.1:2 C.10:1 D.2:1
12. (17分)“套管实验”具有装置简洁便利等有优点,结合图示回答有关问题。
(17分)“套管实验”具有装置简洁便利等有优点,结合图示回答有关问题。
(1) 欲利用图1比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物。最好应在大试管底部加入________________(填化学式),石灰水变浑浊的烧杯有_________(填:甲、乙)
(2) 欲利用图2验证铜与浓硝酸的反应产物,该装置除简洁外,还有一个明显的优点是: 。写出该反应的离子方程式
。
(3) 用锌粒和稀硫酸用图3制取氢气,并收集一试管,锌粒和稀硫酸应放在 试管中(填:大、小)组成发生装置,理由是: 。该反应的离子方程式为: 。
11.(16分)2005年的诺贝尔化学奖颁给了在烯烃复分解反应研究方面做出突出贡献的3位化学家。烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。
如:2CH2=CHCH2CH3 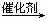 CH2=CH2+CH3CH2CH=CHCH2CH3。
CH2=CH2+CH3CH2CH=CHCH2CH3。
又已知:两个醛分子在一定条件下可以发生加成反应:
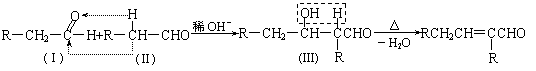
现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
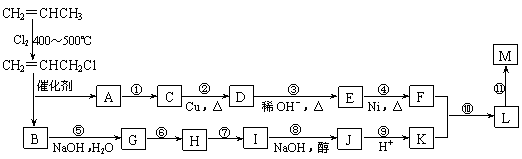
回答下列问题:
⑴反应①的反应类型是:_________________。
⑵反应⑥、⑦中有一反应是与HCl加成,该反应是_____(填反应编号),设计这一步反应的目的是___________________________________ 。
⑶物质M的结构简式为:______________________________________。
⑷写出下列反应的化学方程式:
反应⑧:________________________________________________;
反应⑩:______________________________________________ 。
10. (16分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如右图所示转化关系(这些转化关系都不需要使用催化剂)。
回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是 ;B的电子式是 ,A与甲反应的化学方程式是是 。
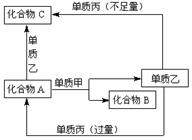 (2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中甲由短周期元素组成,乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中通常条件下进行,则:
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中甲由短周期元素组成,乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中通常条件下进行,则:
①A与乙反应的离子方程式为为: 。
②C与丙反应的离子方程式为: 。
③当A与甲的物质的量之比为2︰3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com