
题目列表(包括答案和解析)
22.(9分)(1)是_______________。(2)原因是_________________________。
(3)
(4)是 ,
方程式为 。
21. (10分)
(10分)
问题1:
问题2:
|
序号 |
实际生产中采取的措施 |
工业生产实例(写名称) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
问题3:化学反应中均伴随着能量的变化。如果一个化学
反应中,反应物的总能量和生成物的总能量有如图所示的
关系,则该反应过程中的能量变化是 。
热量的比是 (保留1位小数)。
问题4:反应物相同,反应物的浓度不同,
反应的原理不同: 。
20.(8分)
(1)为_______个;为_________个;(2)___________。(3)
19.(8分)(1)
(2)
(3)
18. (13分)
⑴ b接 , 接 , 接a。
⑵化学式为 。 ⑶作用是 。
⑷应加在 之间,瓶中可以放入 。
⑸换成 ,如果观察到
(6)
17.(9分)⑴①
②
⑵不合理的是 (3)没有必要的是________________
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
二选择题
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
24.(8分)2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)
的质量为 g。
(4)混合物中Cu2S的质量分数为 。
|
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
(5)若将63 g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
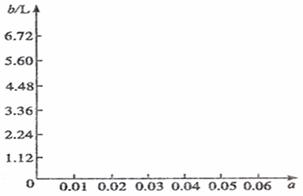 试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
高三年级第一次月考化学试题答题纸
23.(8分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。W是由两种短周期元素组成。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I三种物质中都含有同一种的短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1:2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
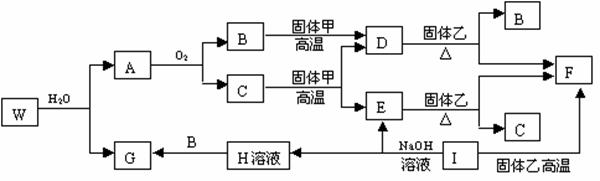

(1)B的电子式为 ,F原子的结构简图______________。
(2)有上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B 等反应中有多个反应属于置换反应,根据要求写出反应式。
非金属元素之间的置换反应__________________________________________;
金属单质置换非金属的置换反应______________________________________;
(3)写出W和水反应的化学方程式_____________________________________。
22.(9分)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,也是浓缩分离铀(U)的原料,游离态的E是经过几代人以生命为代价,最终由莫瓦桑制得而荣获1906年诺贝尔化学奖,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:①a+b=c,②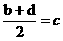 ,③
,③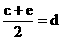 ,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G):
,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G):
(1)A2是最理想的绿色能源,一般情况下固化得到的是分子晶体。20世纪末,美国卡内基实验室曾获得了它的金属晶体,进一步证明了英国物理学家贝纳尔在1925年的预言:“只要创造条件,任何非金属材料都能变成金属”的正确性。你认为由分子晶体A变成金属晶体A的最必要条件是_______________。
(2)铀是重要的战略物资,它有三种同位素: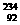 U、
U、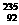 U、
U、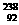 U,其中
U,其中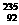 U是核材料。但是
U是核材料。但是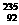 U与
U与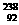 U是形影相随的。分离方法是利用U与E形成UE6气体(E不存在同位素),进行多次扩散纯化分离,请问
U是形影相随的。分离方法是利用U与E形成UE6气体(E不存在同位素),进行多次扩散纯化分离,请问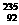 U与
U与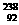 U能进行多次扩散纯化分离的原因是_________________________。
U能进行多次扩散纯化分离的原因是_________________________。
(3)碘的非金属性比G强,请任用一离子方程式表示这一结论:
(4)D的一种单质易溶于水,原因是 ,可用湿润的淀粉碘化钾试纸检验其存在,有关反应的方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com