
题目列表(包括答案和解析)
2.下列离子中外层d轨道达半充满状态的是
A.Cr3+ B. Fe3+ C.Co3+ D .Cu+
1.下列分散系中,分散质微粒直径最大的是
A.雾 B.石灰乳 C.氢氧化铁胶体 D.淀粉溶液
25.(8分)为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确最取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
|
c(H+) |
c(SO42-) |
c(Fe2+、Fe3+) |
|
|
|
|
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42-的关系。
24. (8分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O ;③NO+NO2+2NaOH=2NaNO2+H2O)
(8分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O ;③NO+NO2+2NaOH=2NaNO2+H2O)
(1)若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答。
(2)若仅已知A=0.8,试求B值的范围。
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示)。
23.(12分)⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)- c(M+)= mol/L,c(H+)- c(MOH)= mol/L。
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)弱酸的相对强弱可以用电离常数(K)表示。以HF为例,其电离常数的计算方法是:K=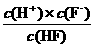 [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
。
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
。
22.(10分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
 2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
21.(8分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
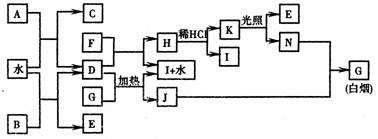
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)单质F与D的反应在工业上有重要的用途,其化学方程式是 。
20.(6分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式: ______ _________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
19.(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A、O4分子内存在极性共价键 B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体 D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中 (填序号)相当于氧分子的还原。
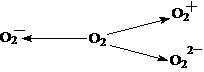
(3)化合物O2[PtF6]中含有O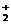 ,有一种常见的含有O
,有一种常见的含有O 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式: __________________________________________
(Ⅱ)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴江苏省大气污染特征是________________
A.煤烟型 B.机动车尾气型 C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵某研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在讨论测定地点时,你建议选择的地点分别是 _____。
 ②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是____________________。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是____________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
HCHO+H2SO3→
该反应类型属于___________________。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右上图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为_____________________________________。
18.(9分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2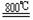 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
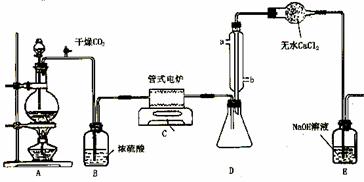
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com