
题目列表(包括答案和解析)
27、(16分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:

(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。(3)通过计算求出原NaOH溶液的物质的量浓度。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
C |
C |
C |
CD |
AC |
CD |
F |
A |
A |
A |
C |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
D |
A |
B |
D |
AD |
C |
B |
C |
B |
C |
|
26、(15分)有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25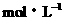 氢氧化钡溶液时,生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时,生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?

(2) A点、B表示的溶液,pH各是多少?
25、(17分)实验室为测定某工业废水中含酚(以苯酚计)量,进行如下操作:
(1)分别称取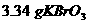 和
和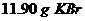 ,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
(2)称取_____________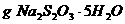 ,用同样方法准确配制
,用同样方法准确配制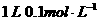 的标准溶液。
的标准溶液。
(3)准确量取100mL含酚(以苯酚计)水样,准确滴加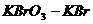 混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成
混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成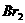 ,立即跟苯酚反应生成沉淀。
,立即跟苯酚反应生成沉淀。
(4)上述反应完成后,再加入约1 g KI,放置5 min,然后用_____________作指示剂,再用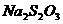 标准溶液滴定至蓝色恰好消失为止(反应为:
标准溶液滴定至蓝色恰好消失为止(反应为: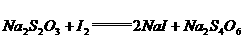 ),用去
),用去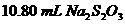 溶液。
溶液。
(5)求水中酚的含量(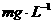 )是否符合国家有关废水允许排放的标准?(国家标准为酸的含量≤
)是否符合国家有关废水允许排放的标准?(国家标准为酸的含量≤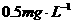 )
)
24、(10分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
① ②
②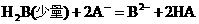
③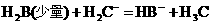
回答下列问题:
1)相同条件下,HA、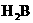 、
、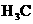 三种酸中酸性最强的是_______________________.
三种酸中酸性最强的是_______________________.
2)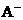 、
、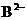 、
、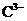 、
、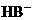 、
、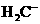 、HC2- 6种离子中,最易结合质子的是________,
、HC2- 6种离子中,最易结合质子的是________,
最难结合质子的是________.
3)判断下列反应的离子方程式中正确的是(填写标号)__________________________.
A.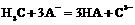 B.
B.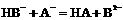 C.
C.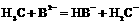
4)完成下列反应的离子方程式.
A.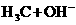 (过量)__________________________;
(过量)__________________________;
B.HA(过量) __________________________.
__________________________.
23、(6分)限用下列试剂:酚酞、石蕊、稀硝酸、CH3COONa晶体、浓盐酸、Ca(OH)2粉末、CH3COONH4 晶体和蒸镏水。根据:①弱酸在水中存在电离平衡;②弱酸根阴离子会破坏水的电离平衡。这两个平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两个实验方案证明CH3COOH是弱酸,请简述实验方法及现象。
(1)应用根据①的实验方法及现象 。
(2)应用根据②的实验方法及现象 。
22、(6分)已知25℃时,0.1mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了OH-浓度,因而溶液的pH增大;
乙同学认为醋酸钠溶于水可电离出大量的CH3COO-离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大。
对上述两位同学的解释你认为哪种是正确的?为了验证上述哪种解释正确,你怎样利用下列所给的哪种物质进行怎样的实验?
A.CH3COOK固体 B. CH3COONH4固体 C. 氨气 D. NaHCO3固体
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________
21、(21分)含有NaOH,Na2CO3,NaHCO3中的一种或两种物质组成的混合溶液,为确定其成分,用标准盐酸滴定。用酚酞作指示剂时,耗用标准盐酸的体积为V1L,酚酞的变色范围8~10,当酚酞由红经粉红恰好变为无色时,加入甲基橙指示剂,用标准盐酸继续滴定,当甲基橙由黄变橙时,又耗用V2L盐酸,甲基橙变色范围是3.1~4.4(NaHCO3不能使酚酞试液显红色)
当V1,V2的关系如下时,盐酸的物质的量浓度为Mmol/L时,填写溶液的成分和它们的物质的量。
(1)V1≠0,V2=0:成分: ,物质的量
(2) V1=0,V2≠0成分: ,物质的量
(3) V1= V2≠0成分: ,物质的量
(4) V1> V2>0成分: ,物质的量
(5) V2> V1>0成分: ,物质的量
20、化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)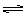 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02mol·L-1的下列各溶液(1)盐酸(2)石灰水(3)NaCl溶液(4)NaHSO4溶液(5)NaHCO3溶液(6)氨水,其中能使指示剂显红色的是
A.(1)(4)(5) B.(2)(5)(6) C.(1)(4) D.(2)(3)(6)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
19、把0.05 mol NaOH (s) 分别加入100mL下列溶液中,溶液的导电能力变化最小的是
A.自来水 B. 0.5mol/L的盐酸
C.0.5mol/L的醋酸 D. 0.5mol/L的KCl溶液
18、已知K2HPO4溶液中,HPO42―的水解程度大于电离程度,对于平衡:HPO42― + H2O H3O+ + PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-) 三种离子溶度均减小,可采用的方法是
A. 加水 B. 加热 C. 加消石灰 D. 加硝酸银
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com