
题目列表(包括答案和解析)
10.在273K和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是
A.6.72L B.7.84L C.10.08L D.13.44L
9.下列有关试剂的保存方法,错误的是
A 浓硝酸保存在无色玻璃试剂瓶中
B 少量的钠保存在煤油中
C 氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
D 新制的氯水通常保存在棕色玻璃试剂瓶中
8. 下列各组热化学方程式程中,化学反应的△H前者大于后者的是
下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2 (g)=CO(g); △H2
②S(s)+O2(g)=SO2(g); △H3 S(g)+O2 (g)=SO2 (g); △H4
③H2(s)+1/2O2(g)=H2O(g); △H5 2H2(g)+O2 (g)=2H2O (l); △H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2 (s);△H8
A ① B ④ C ②③④ D ①②③
7.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价.NaH与水反应放出氢气.下列叙述中, 正确的是
(A)NaH在水中显酸性 (B)NaH中氢离子的电子层排布与氦原子的不同 (C)NaH中氢离子半径比锂离子半径大 (D)NaH中氢离子可被还原成氢气
6.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO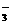 、NO
、NO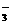 B.Na+、SO
B.Na+、SO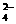 、Cl-、ClO-
、Cl-、ClO-
C.H+、Mg2+、SO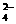 、NO
、NO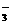 D.Ag+、K+、NO
D.Ag+、K+、NO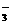 、Na+
、Na+
5.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.在25℃和101kPa下, aL甲烷和乙烷混合气体中的分子数约为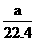 ×6.02×1023
×6.02×1023
4.下列离子方程式中正确的是
A H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-=BaSO4↓+H2O
B Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C CH3COOH溶液与NaOH溶液反应:H++OH-=H2O
D Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3-
3.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I- = 2Fe2+ + I2
2.下列反应中生成物总能量高于反应物总能量的是
A 碳酸钙受热分解 B 乙醇燃烧
C 铝粉与氧化铁粉末反应 D 氧化钙溶于水
1.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温
2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com