
题目列表(包括答案和解析)
12.1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
11.下列反应离子方程式正确的是
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH-=AlO2- + 2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O-→2C6H5OH + CO32-
C.向小苏打溶液中加入醋酸溶液:HCO3-+ HAc=Ac-+CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br-+ 2Cl2=Fe3+ + Br2 + 4Cl-
10.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:

9.t℃时,将100g某物质A的溶液蒸发掉10g水,恢复至t℃,析出2.5g晶体。再蒸发掉10g水,恢复至t℃,析出7.5g晶体。下列说法中不正确的是
A.t℃时原100g溶液是饱和溶液
B.若析出的晶体中不含结晶水,则可计算出t℃时A的溶解度
C.若析出的晶体中含有结晶水且已知晶体的化学式和相关元素的相对原子质量,就可以计算出t℃时A的溶解度
D.根据题给条件可以计算出原溶液溶质的质量分数
8.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A.All4与ⅡA族元素性质相似
B.A113与卤素性质类似
C.A113在气相中与HI反应的方程式可表示为:A113+HI=HAl13I
D.A113超原子中A1原子间是通过离子键结合的
7.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42-、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、NO3-、I-
6.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g) ;△H>0
B.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l); △H>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ;△H<0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;△H<0
5.设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
B.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数为0.2 NA
C.1L 0.1mol·L-1的醋酸溶液中的分子总数大于0.1NA
D.通过化学反应制得1mol O2,转移电子的数目一定是4NA
4.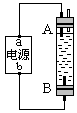 某学生设计了一种电解法制取Fe(OH)2的实验装置。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中不正确的是
某学生设计了一种电解法制取Fe(OH)2的实验装置。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中不正确的是
A.电源中的a 为正极,b为负极
B.可以使用NaCl溶液作电解液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应为2H2O+2e-=H2↑+2OH-
3.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维,聚酯纤维的结构简式为:
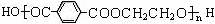 ,则下列说法不正确的是
,则下列说法不正确的是





A.羊毛与聚酯纤维的化学成分不相同
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇
D.由单体合成聚酯纤维的反应属加聚反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com