
题目列表(包括答案和解析)
25.(8分)将铁粉与氧化铁的混合物19.2g,加入200mL稀H2SO4,放出3360mL氢体(标况),反应后溶液中无固体剩余。向反应后的溶液里加入KSCN溶液,不呈血红色。中和过剩的酸,并将全部Fe2+沉淀为Fe(OH)2,共用去4mol/L NaOH溶液200mL。
求:
(1)原混合物中Fe2O3的质量分数;
23.(4分)FeCl3的浓溶液溶解铜粉的离子方程式为:2Fe3++Cu=2Fe2++Cu2+。现向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入bg铁粉,经充分反应后,过滤,得cg滤渣。若已知a>b>c,试推断滤渣是 ,滤液中的金属离子是 。
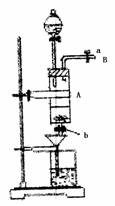 24.(12分)三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,YC此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分开水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。请填写下列空白:
24.(12分)三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,YC此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分开水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。请填写下列空白:
(1)从B导管收集产生的气体可采用的方法是 。
(2)滴加盐酸时,发现反应速率比盐酸与纯铁粉反应要快,
其原因是 。
(3)烧杯内放过量稀HNO3的原因是 ,
离子方程式是 。
(4)整个实验过程中,弹簧夹a都必须打开,除了为排出产生
的气体外,另一个目的是 。
(5)用降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来
制得晶体的理由 。
21.(8分)有A、B、C、D、E、F、G、W八种气体,进行如下实验:
(1)分别将八种气体通入水中发现E、F难溶于水,其它气体可溶,其中A、D极易溶于水,W溶于水时有F气体生成
(2)A经催化氧化得F,C在空气中充分燃烧可得G
(3)C、D遇酸化的硝酸银分别有黑色沉淀和白色沉淀生成
(4)B与E化合得D,D与A相遇有大量白烟生成;
则:
A ,B ,C ,D ,E ,F ,G ,W ;
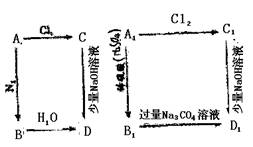 22.(8分)A和A1是同一周期的元素,在A和A1的如下图各步反应中,最后生成的D和D1均有白色沉淀。试推断:A、B、C、D;A1、B1、C1、D1,写出它们的化学式。
22.(8分)A和A1是同一周期的元素,在A和A1的如下图各步反应中,最后生成的D和D1均有白色沉淀。试推断:A、B、C、D;A1、B1、C1、D1,写出它们的化学式。
A B
C D
A1 B1
C1 D1
20.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)正确的是 ( )
A.向1L浓度均为0.1mol/L的Ba(OH)2、NaAIO2混合液加入0.1mol/L稀H2SO4
B.向含有0.1mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液
C.向氢氧化钡溶液中滴加明矾溶液
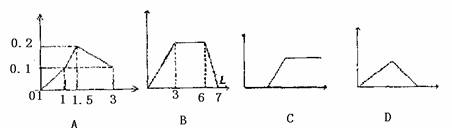 D.向AlCl3溶液滴加过量氨水
D.向AlCl3溶液滴加过量氨水
19.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO、NaCI中的一种或几种组成,将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定)若将原混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体质量大于原混合粉末的质量,下列判断正确的是 ( )
A.粉末中一定有Na2O、Na2O2、NaHCO3
B.粉末中一定不含有Na2CO3和NaCI
C.粉末中一定不含有Na2O和NaCI
D.无法肯定粉末里是否含有Na2O2和NaCI
18.下列离子方程式中,正确的是 ( )
 A.向氯化亚铁溶液中通入氯气Fe2++CI2 Fe3++2CI-
A.向氯化亚铁溶液中通入氯气Fe2++CI2 Fe3++2CI-
 B.二氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O Fe(OH)3↓3NH+4
B.二氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O Fe(OH)3↓3NH+4
 C.钠与水的反应Na+2H2O Na++2OH-+H2↑
C.钠与水的反应Na+2H2O Na++2OH-+H2↑
D.氯气通入冷水中CI2+H2O=2H++CI-+CIO-
17.在25℃时将两个不溶性电极插入一定量的硫酸钠饱和溶液中进行电解,电解一段时间后,阴阳极两极共逸出3a摩气体,同时有W克十水硫酸钠晶体析出,若温度不变,则原溶液中溶质的质量分数为 ( )
A.W/(W+54a)×100% B.71W/161(W+36a)×100%
C.W/(W+36a)×100% D.71W/161(W+54a)×100%
16.用两个质量都等于10.2克铜棒作电池插入硝酸银溶液中,接通直流电源,当阴极通入0.1摩电子时,溶液中还有大量的银离子,这时,阴阳两极的质量比为 ( )
A.21:10.2 B.10.2:21 C.3:1 D.1:3
15.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
( )
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
14.将x、y、z、w四块金属分别用导线两两相连浸入稀硫酸中组成原电池。x、y相连时,x为负极;z、w相连时,电流由w→z;z、x相连时,z极上产生大量气泡;w、y相连时,w极发生氧化反应。据此判断四种金属的活动顺序是 ( )
A.x>z>w>y B.z>x>y>w C.x>y>z>w D.y>w>z>x
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com