
题目列表(包括答案和解析)
8.下列物质为固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
7.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
6.在电解水制取H2和O2Y时,为了增强导电性,常常加入一些电解质,最好选用下列物质
中的 ( )
A.NaOH B.HCl C.NaCl D.CuSO4
5.下列有关热化学方程式的说法中不正确的是 ( )
A.热化学方程式未注明温度和压强时,△H表示标准状况下的数据
B.热化学方程式中的化学计量数只代表反应物或生成物的物质的量
C.在加热或点燃条件下才能进行的化学反应既可以为放热反应,也可以为吸热反应
D.同一化学反应化学计量数不同,△H值不同。化学计量数相同而状态不同,△H值
也不同
4.多粉尘工厂如冶金、水泥等常将废气通过高压电的“电除尘器”,使粉尘基本除去,其
主要原理是 ( )
A.发生电泳,使粉尘于电极板上凝聚
B.高压电促使粉尘转化为气体
C.高压电使粉尘在空间形成沉淀而沉降
D.高压电因电场强烈有类似于过滤的作用
3. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用,它的充电放电反应按下式进
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用,它的充电放电反应按下式进
行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极
材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
2.下列物质中,化学式能准确表示该物质分子组成的是 ( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2)
C.白磷(P4) D.硫酸钠(Na2SO4)
1.在常温常压下呈气态的化合物、降温使其固化得到的晶体属于 ( )
A.分子晶体 B.原子晶体
C.离子晶体 D.何种晶体无法判断
32. (12分)
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液。所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
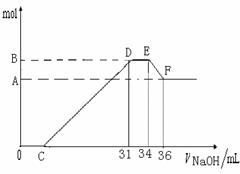
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为---------------------------(填化学式)。
(2)完成下列过程中的离子反应方程式:
O→C_______________________________________________________________;
D→E________________________________________________________________;
E→F_______________________________________________________________;
(3)B值是多少mol?写出计算过程。
31.(14分)
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为
。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com