
题目列表(包括答案和解析)
5.在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2 vB =3 vA、
3 vC = 2vB,则此反应可表示为 ( )
A.2A + 3B = 2C B.A + 3B = 2C
C.3A + B = 2C D.A + B =C
 6.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
6.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
A.4>2>1>3>5 B.2>1>5>3>4
C.5>4>2>3>1 D.3>5>2>4>1
4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN3的晶体结构为 ( )

2.下列各原了或离子的电子排布式错误的是 ( )
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
1.遇有下列情况,及时处理有误的是 ( )
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C.金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
25.(11分)已知pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟
用电解CuSO4溶液的方法测定铜的相对原子质量。其实验流程如下图所示:
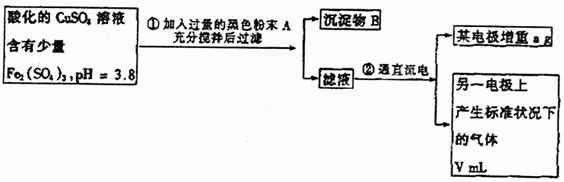
试回答下列问题:
(1)步骤①所加入的A的化学式及加入A的作用是( )
a. Fe2O3;抑制Fe3+水解
b. CuO;与H+反应,调节溶液pH在4~5间使Fe3+完全水解
c. CuO;与Fe(SO4)3发生氧化还原反应
(2)步骤②中所用部分仪器如图所示:则A应接直流电源的 极。B电极上发生的电极反应式为 。
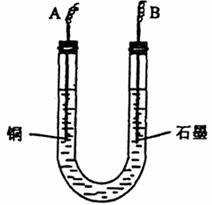
(3)下列实验操作属不必要的是 (填字母)
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.低温烘干电极后称量
E.再次低温烘干后称量至恒重
(4)电解后向溶液中加入石蕊试液,观察到的现象是 。
(5)铜的相对原子质量的计算式为 。
(6)步骤②的变化中,从能量转化的角度看是 能转化为 能。
24.(12分)氢氧化钠是一种用途广泛的重要化工原料。工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。我国一般采用离子交换膜法制烧碱
(1)写出电解饱和氯化钠溶液时的电极反应和总化学反应方程式
阳极:
阴极:
总反应式:
(2)离子交换膜电解槽一般采用金属钛做阳极,碳钢网做阴极,阳离子交换膜把电解槽隔成阴极室和阳极室,阳离子交换膜的作用是
(3)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子。使用的试剂有:a. Na2CO3溶液,b. Ba(OH)2溶液,c. 稀盐酸。
其合理的加入顺序为 (填试剂序号)。
(4)如果在10L的离子交换膜电解槽中,1 min在阳极上可产生11.2L标准状况下的Cl2,这时溶液的pH是 (假设此温度下水的离子积Kw=1×10-14且溶液体积不变)
23.(10分)化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等等。
(1)下列△H表示物质燃烧热的是 ;表示物质中和热的是 ;
(填△H1,△H2和△H3等)
A.2H2(g)+O2(g)=2H2O(l);△H1
B.C(s)+1/2O2(g)=CO(g);△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H3
D.C(s)+O2(g)=CO2(g);△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H8
(2)在101kPa时,4.0g硫粉在氧气中完全燃烧生成SO2,放出37kJ的热量,S的燃烧热为 ,S燃烧的热化学方程式为 。
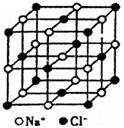 21.(14分)NaCl晶胞的结构如图所示,
21.(14分)NaCl晶胞的结构如图所示,
(1)晶体中每个Cl-同时吸引着 个Na+,每个Na+同时吸引着
个Cl-,每个Na+同时吸引着 个Na+。
(2)每个NaCl晶胞中平均有 个Na+ 个Cl-
(3)一定温度下,用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度?
22.(8分)根据国家环保局的统一规定,目前进行常规大气监测的项目是:二氧化硫、氮
氧化物、悬浮颗粒物三种大气污染物。
(1)空气中二氧化硫主要来源于
A.森林遭到乱砍滥伐,破坏了生态平衡
B.汽车排出的尾气
C.工业上大量燃烧含硫的燃料
D.大气中二氧化碳含量增多
(2)在下列情况中可能引起大气污染的是
①煤的燃烧 ②工业废气任意排放
③燃烧鞭炮 ④飞机、汽车尾气的排放
A.①② B.②④ C.①②③ D.①②③④
(3)二氧化硫是工业制硫酸中的必要物质,我国目前多用燃烧黄铁矿(FeS2)的方法来制取二氧化硫,这个反应常在 (填设备)内进行;该反应的化学方程式为 。
20.能够使反应Cu+2H2O=Cu(OH)2↓+H2发生,且Cu(OH)2能立即在电极上析出的是
A.铜片作原电池的负极,碳棒作原电池的正极。氯化钠溶液作电解质溶液
B.用铜片作阴阳极,电解硫酸钠的水溶液
C.用铜片作阴阳极,电解氢氧化钠的水溶液
D.用铜片作阴阳极,电解硫酸铜的水溶液
第Ⅱ卷(共计55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com