
题目列表(包括答案和解析)
2.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B. 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101KPa时 , 1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+01n→14C+11H,下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.地球上活着的生物体内,由于新陈代谢作用也存在14C D.14CO2的摩尔质量为46
 27.(12分)维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
27.(12分)维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
(1)下列说法中正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作批示剂
C.滴定时可用甲基橙作指示剂 D.锥形瓶不能用待测橙汁润洗
(2)上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL。除玻璃棒外,还需要的玻璃仪器有 等(填编号)
A.容量瓶 B.烧杯 C.维形瓶 D.烧瓶
(3)标准碘液放入 (填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是 。
(4)滴定过程中能否剧烈摇动锥形瓶 (填能或不能),为什么
。
(5)若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是 mg/L该橙汁 (填“是”或“不是”)纯天然的新鲜橙汁
28.(12分)某种含有少量氧化钠的过氧化钠试样(试样质量为1.560g、锥形瓶和水的质190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
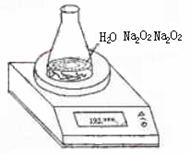
|
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
 (3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
26.(7分)我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
①已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。写出偏二甲(基)肼分子的化学式和结构简式:化学式 ,结构简式 。
②在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2) 。
25.(11分)已知-NH3连在苯环上显碱性 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(1)既有酸性又有碱性 ;
(2)只有酸性 ;
(3)只有碱性 ;
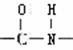 (4)显中性
。
(4)显中性
。
(5)由于-COOH能跟-NH2形成 ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)]。该化合物为高强度纤维材料,其结构简式为 。
24.(10分)有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的。流程图中:A和M (C3HO)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。

(1)写出
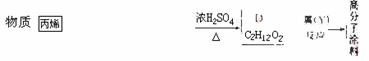
(2)
(3)N+ O2 M O2
(4)反应 催化剂→C3H4O催化剂
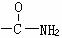
23.(10分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值 (填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
 CO (g) + H2O
(g) CO2
(g) + H2 (g) △H<0
CO (g) + H2O
(g) CO2
(g) + H2 (g) △H<0
CO和H2O浓度变化如下图,则O-4min的平均反应速率v (CO) = mol / (L·min)
 t℃时物质浓度(mol/L)的变化
t℃时物质浓度(mol/L)的变化
|
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min-4min之间反应处于 状态;
C1数值 0.08mol / L(填大于、小于或等于)。
②反应在4 min-5min间,平衡向逆方向移动,可能的原因是 (单选),
表中5 min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
22.(8分)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列是 。
(2)当它们的物质的量浓度相同时,其pH由大到小排列是 。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反需烧碱溶液的体积关系为 。
21.(10分)Ⅰ.下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
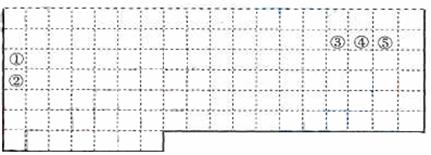
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多 个,元素③氢化物的电子式为 。
(3)元素④一般在化合物中显 价,但与 形成化合物时,所显示的价态则恰好相反。
 (4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是
。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是
。
a.元素①的单质 b.元素②的单质
c.元素①②形成的合金 d.无法判断
Ⅱ.已知NaCl的摩尔质量为Mg·mol-1,食盐晶体的密度
为ρg·cm-3,若右图中Na+与最邻近的Cl-的核间距离
为acm,那么阿伏加德罗常数的值可表示为
20.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是 ( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1 mol物质得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaCl3 + H2SO4= 2Na2SO4 + 2ClO2↑+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com