
题目列表(包括答案和解析)
25.某学生为了测定某种稀硫酸的物质的量浓度,用不同质量的纯锌粉与该稀硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
|
实验编号 |
加入锌粉的质量(g) |
稀硫酸溶液的体积(mL) |
生成硫酸锌的质量(g) |
|
1 |
2.0 |
50.0 |
5.0 |
|
2 |
4.0 |
50.0 |
|
|
3 |
6.0 |
50.0 |
14.9 |
|
4 |
8.0 |
50.0 |
19.3 |
|
5 |
10.0 |
50.0 |
|
|
6 |
12.0 |
50.0 |
19.3 |
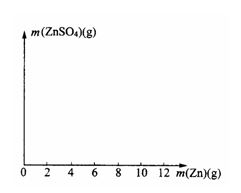 (1)其中第2、第5两个实验中生成硫酸锌的质量分别
(1)其中第2、第5两个实验中生成硫酸锌的质量分别
是 g、 g。
(2)在右图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉质量[m(Zn)]的关系示意图(需要标明关键点的横坐标和纵坐标的数据)。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为__________g,该稀硫酸的物质的量浓度为________mol/L。
24.有硫酸钾和碳酸镁的混合物,用50 mL 盐酸完全溶解后,在标准状况下收集到0.56L二氧化碳,向反应后的溶液中加入含有0.03 mol氢氧化钡的溶液,可得到6.11g沉淀,此时溶液的pH=12,溶液的体积为200mL,试求:
(1) 原混合物中碳酸镁的质量(2) 得到的沉淀中硫酸钡的质量(3) 盐酸的物质的量浓度
23.目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO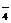 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO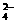 。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:



 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过

 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:
(3)若气体流速管中气体流速为a cm3/min,当t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)实验中棉花的作用是______________________________________________;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是
。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):
_______________________________________________________________。
22、酸雨主要是燃烧含硫的燃料引起的,现有一份雨水样品,每隔一定时间对它的PH值测定一次。
①雨水样品的pH变化的原因是(用化学方程式表示) ;
②如果将刚取样的上述雨水与自来水相混合,pH将变 ,原因是(用化学方程式表示) 。
③为防治酸雨,降低煤燃烧时向大气排放的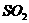 ,工业上将生石灰和含硫煤混合后使用,请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:
,工业上将生石灰和含硫煤混合后使用,请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:
, 。
21.已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A、B均是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①-③是化学工业生产重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。
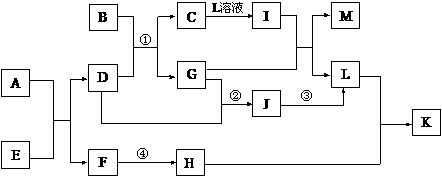
请填写下列空白:
(1)写出下列物质的化学式:H_________;D的同素异形体__________。(均填化学式)
(2)画出A中金属元素的原子结构示意图_____________;指出E分子中共价键的类型(填“极性键”或“非极性键”)____________。
(3)指出反应①②③是吸热反应,还是放热反应?____________。
(4)完成下列反应方程式:① I+G→M+L的离子方程式:_______________________________。
② 写出反应④的化学方程式:_____________________________________。
|
测试时间(小时) |
0 |
1 |
2 |
4 |
8 |
|
雨水 PH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
20.有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学 式 、 。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其
中的虚线表示 ,与每个“构成粒子”相邻的粒子呈 空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为 。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热:___________________________________________。
19、某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应,反应式可能为:2 Na2O2+2SO2=2Na2SO3+O2,为此设计如下一套装置,来验证Na2O2和SO2的反应产物。如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。回答下列问题:
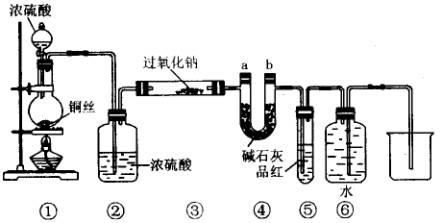
 (1)点燃①处酒精灯,不久,观察到①处产生大量气体;
③处两通管管壁发热,管内药品的颜色变化为:____________色逐渐变为__________色。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?___________________。
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
。
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
。
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因。___________________________。
(1)点燃①处酒精灯,不久,观察到①处产生大量气体;
③处两通管管壁发热,管内药品的颜色变化为:____________色逐渐变为__________色。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?___________________。
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
。
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
。
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因。___________________________。
18.碱式氯化铜(不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O
(X=1/2,1,2)为验证其组成并确定X值,某学生设计了以下几步实验。
① 取a g的晶体制成粉末。
② 晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③ 另取a g的晶体,溶于足量某溶剂中充分溶解得到溶液。
④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器 (填仪器名称,下同);灼烧晶体时是在 中进行。以上四步中,用到玻璃棒的步骤有 (选填:①②③④)
B.步骤②灼烧后得到的固体应为:
C.步骤③所用的溶剂可能是
D.步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量
E.若组成符合通式,则计算X的表达式为: (用字母表示)。
17.实验室制取氯气的方法有多种,下列所列物质是制取氯气的某一反应的部分反应物和生成物:HCl、K2Cr2O7、CrCl3、H2O请根据可能的反应原理,完成正确的化学方程式,并用单键头表示电子转移的情况,同时指出反应中的氧化剂和氧化产物。
氧化剂: 氧化产物:
16.在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300oC,经充分反应后排出气体,则残留固体及其物质的量正确的是( )
|
|
A |
B |
C |
D |
|
反应前 |
1molNaOH、1molNaHCO3 |
1molNa2O、1molNaHCO3 |
1mo1Na2O2、lmolNaHCO3 |
1molNa2O2、1molNH4HCO3 |
|
反应后 |
1molNa2CO3 |
2molNaOH、0.5molNa2CO3 |
2molNaOH、0.5molNa2CO3 |
1molNa2CO3 |
班级 姓名 学号 得分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com